  FIGURA 2-2 FIGURA 2-2
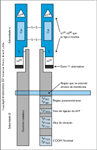
Estrutura do receptor de insulina. O receptor de insulina é necessário para mediar a ação da insulina. Produto de um gene de cópia única localizado no braço curto do cromossomo 19 (banda citogenética 19p13), o receptor de insulina é sintetizado como um precursor polipeptídico de cadeia única que sofre clivagem pós-tradução, formando subunidades a e b separadas, que formam heterodímeros que são exportados para a membrana plasmática. Durante a maturação, o receptor é glicosilado e acilado, formando um heterotetrâmero composto de duas subunidades a e duas b (a2–b2). A subunidade a é inteiramente extracelular e contém sítios de ligação de alta e baixa afinidade pela insulina (a1–a2). As moléculas assimétricas de insulina interagem com as subunidades a através da ligação a um sítio de a1 e de a2 nas subunidades subjacentes. A subunidade b transpõe a membrana plasmática uma vez e se liga à subunidade a através de pontes dissulfeto e interações não-covalentes. A parte intracelular da subunidade b contém um domínio de proteína quinase específica de tirosina. A ligação da insulina ao domínio extracelular causa uma modificação conformacional no domínio intracelular de tal forma que o receptor sofre autofosforilação e pode se ligar ao trifosfato de adenosina (ATP).Vários resíduos de tirosina são fosforilados, inclusive a tirosina 972, que promove ligação ao substrato e fosforilação [20,23]. Sítios específicos de fosforilação no domínio catalítico (tirosina 1158, 1162 e 1163) são essenciais para promover a atividade de quinase do receptor em direção a outros substratos proteicos [24]. O papel dos sítios de fosforilação carboxiterminais (tirosina 1328 e 1334) é mais controverso, com alguns investigadores sugerindo que esses sítios possam desempenhar um papel na estimulação da atividade mitogênica do receptor. O receptor de insulina é expresso como duas isoformas de diferentes splicings, resultantes da inclusão (isoforma B) ou da exclusão (isoforma A) do éxon-11 durante o processamento do RNA mensageiro (mRNA). O éxon 11 codifica um peptídio de 12 aminoácidos localizado na extremidade carboxiterminal da subunidade a do receptor, que reduz a afinidade pela insulina [25]. Uma desregulação do splicing do gene do receptor de insulina altera os padrões de crescimento fetal e contribui para a resistência à insulina em adultos [14,25].
voltar |