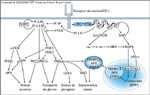
 FIGURA 2-6 FIGURA 2-6
As proteínas de substrato do receptor da insulina (IRS – insulin receptor substrate) coordenam várias vias de sinalização a jusante. A diversidade da ação da insulina em diferentes tecidos é parcialmente explicada pelos diferentes produtos acoplados às vias ativadas pelo hormônio. Há dois ramos principais que propagam o sinal gerado através do receptor da insulina: o ramo da fosfatidil 3-quinase (PI 3-K) e o ramo da proteína quinase ativada por Ras/mitógeno. As proteínas IRS se ligam a PI 3-K, Grb2/SOS e SHP-2. O complexo GRb2/SOS medeia a ativação de p21ras, ativando desta forma a cascata ras raf raf metiletilcetona (MEK) metiletilcetona (MEK)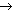 proteína quinase ativada por mitógeno (MAP). O SHP2 retroalimenta para inibir a fosforilação de proteína IRS através da desfosforilação direta da proteína IRS, mas também poderia transmitir um sinal independente para ativar a MAP quinase. A MAP quinase ativada fosforila p90rsk que, por sua vez, fosforila o fator de transcrição c-fos, aumentando sua atividade transcricional. Da mesma forma, a MAP quinase fosforila elk1, aumentando sua atividade transcricional. A ativação da PI 3-K pelo recrutamento da proteína IRS resulta na geração de PI 3,4P2 e PI 3,4,5P3 (antagonizada pela ação de PTEN ou SHIP2). Juntos, PI 3,4P2 e PI 3,4,5P3 ativam várias quinases, inclusive mTOR, isoformas atípicas de PKC e proteína quinase dependente de fosfoinositídeo (PDK1). A PDK1 está a montante de PKB, o que promove o transporte de glicose; as isoformas atípicas de PKC também desempenham um papel. A PKB também regula GSK3, que poderia regular a síntese de glicogênio e uma variedade de reguladores de sobrevida celular; a fosforilação de BAD mediada pela PKB inibe a apoptose. A PKB também fosforila os fatores de transcrição 'forkhead' (como o Foxo1), que restringe sua localização ao citoplasma e inibe sua atividade transcricional. PKB — proteína quinase B; GAP — proteína associada à guanosina trifosfatase; GLUT4 — transportador-4 de glicose; GRB-2 — proteína-2 de ligação ao receptor do fator de crescimento 2; GSK3 — glicogênio-sintase quinase 3; MAPKK — MAP quinase quinase; PKC — proteína quinase C; SOS — son-of-sevenless. proteína quinase ativada por mitógeno (MAP). O SHP2 retroalimenta para inibir a fosforilação de proteína IRS através da desfosforilação direta da proteína IRS, mas também poderia transmitir um sinal independente para ativar a MAP quinase. A MAP quinase ativada fosforila p90rsk que, por sua vez, fosforila o fator de transcrição c-fos, aumentando sua atividade transcricional. Da mesma forma, a MAP quinase fosforila elk1, aumentando sua atividade transcricional. A ativação da PI 3-K pelo recrutamento da proteína IRS resulta na geração de PI 3,4P2 e PI 3,4,5P3 (antagonizada pela ação de PTEN ou SHIP2). Juntos, PI 3,4P2 e PI 3,4,5P3 ativam várias quinases, inclusive mTOR, isoformas atípicas de PKC e proteína quinase dependente de fosfoinositídeo (PDK1). A PDK1 está a montante de PKB, o que promove o transporte de glicose; as isoformas atípicas de PKC também desempenham um papel. A PKB também regula GSK3, que poderia regular a síntese de glicogênio e uma variedade de reguladores de sobrevida celular; a fosforilação de BAD mediada pela PKB inibe a apoptose. A PKB também fosforila os fatores de transcrição 'forkhead' (como o Foxo1), que restringe sua localização ao citoplasma e inibe sua atividade transcricional. PKB — proteína quinase B; GAP — proteína associada à guanosina trifosfatase; GLUT4 — transportador-4 de glicose; GRB-2 — proteína-2 de ligação ao receptor do fator de crescimento 2; GSK3 — glicogênio-sintase quinase 3; MAPKK — MAP quinase quinase; PKC — proteína quinase C; SOS — son-of-sevenless.
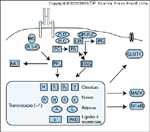 FIGURA 2-7 FIGURA 2-7
Membros da família PKC das serina/treonina quinases estão implicados em várias ações da insulina. Há dois subgrupos de PKCs. As isoformas PKC “clássicas” se ligam ao cálcio para ativação. As PKCs atípicas são ativadas pela ligação com o diacilglicerol (DAG) ou com outros fosfolípides, como fosfatidilinositol 3,4,5-trisfosfato (PIP3). A insulina ativa diferentes membros desta família de quinases através da formação de DAG e PIP3. A insulina estimula a formação de DAG através da hidrólise da fosfatidilcolina (PC) em DAG e ácido fosfatídico (PA) ou através da atividade de uma fosfolipase-C específico de glicosil-fosfatidilinositol (GPI-PLC), levando à formação de DAG inositol-fosfoglicana (IPG). Foi demonstrado que diferentes formas de PKC sofrem translocação do citosol para a membrana em resposta à estimulação da insulina em diferentes tecidos. Existem evidências de que este processo possa ser importante para a atividade biológica das PKCs [42]. Sabe-se que as PKCs podem ativar diretamente a via da MAP quinase e o fator de transcrição NF-kB, levando a um aumento de expressão gênica e síntese proteica. Mais recentemente, emergiram evidências de que a ativação de PKCs atípicas pelo PIP3 possa ser importante no processo de transporte de glicose insulino-dependente [43].
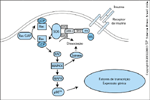 FIGURA 2-8 FIGURA 2-8
A via de sinalização Ras desempenha um papel importante no crescimento e transformação celular [38]. A insulina ativa a via Ras, levando a uma maior síntese proteica e mitogênese. A ativação do Ras em resposta à insulina exige a formação de um complexo de sinalização entre o substrato do receptor da insulina (IRS – insulin receptor substrate) ou shc (src homology 2/collagen homology-containing protein) e a proteína-2 de ligação ao receptor do fator de crescimento (GRB-2 – growth factor receptor binding protein 2). A GRB-2 consiste em um domínio SH2 que se liga aos resíduos fosforilados de tirosina no IRS ou shc, e em dois domínios SH3 (src homology 3 motif) que reconhecem motifs ricos em prolina no fator de ‘permuta son-of-sevenless’ (SOS). O SOS cataliza a conversão do Ras de uma forma inativa (ligada ao difosfato de guanosina) para uma forma ativa (ligada ao trifosfato de guanosina). Uma rasGAP catalisa a reação reversa, com a formação de Ras inativo. Ras-GTP ativa a Raf quinase, que fosforila a quinase da proteína quinase ativada por mitógeno (MAPKK). A MAPKK fosforila quinases de regulação extracelular Erk1/2, que estimulam outras quinases, inclusive p90rsk, que promove síntese proteica e expressão gênica. Ao ser ativada, a MAPKK também ativa vias adicionais que catalisam a dissociação de GRB-2 do SOS, que finaliza o sinal. Parece que os papéis relativos do IRS e shc na ativação de SOS através de GRB-2 variam em diferentes tecidos [44].
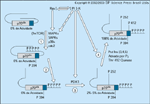 FIGURA 2-9 FIGURA 2-9
A insulina regula a p70s6 quinase, que promove síntese proteica e proliferação celular. A p70s6k ocorre como duas isoformas denominadas S6K1 e S6K2. Um distúrbio em s6k1 causa intolerância à glicose por causa do tamanho reduzido das células b de ilhota; em contraste, a ação periférica da insulina poderia ser amplificada, sugerindo que a S6K1 inibe a sinalização da insulina [45]. A S6K1 será ativada in vivo através de eventos de fosforilação em múltiplos sítios em resposta à insulina e a outros mitógenos se estiver disponível um suprimento suficiente de aminoácidos ou em resposta a altas concentrações de aminoácidos isoladamente [46]. Portanto, acredita-se que a p70s6k seja um sensor de nutriente [47]. Uma variedade de quinases direcionadas pela prolina, entre elas a Erk, a Cdc2 e a mTOR, fosforila vários sítios na p70s6k, inclusive sítios Ser/Thr-Pro no domínio auto-inibitório de pseudo-substrato da cauda carboxiterminal (Ser434, Ser441, Thr444, Ser447 e Ser452) bem como sítios na extensão do domínio catalítico (Thr390 e Ser394) [46]. A fosforilação do domínio auto-inibitório de pseudo-substrato serve para desengatar a cauda carboxiterminal, possibilitando o acesso a Thr252 e Thr412. A PDK1 catalisa a fosforilação de Thr252 na alça de ativação do domínio catalítico, que aumenta ligeiramente a atividade da quinase e facilita a fosforilação de Thr412 estimulada por PtdIns (3,4,5)P3, que é a etapa limitante de velocidade na ativação. A fosforilação concomitante de Thr252 e Thr412 aumenta a atividade da p70s6k em 20 a 30 vezes [39]. A desativação da p70s6k que ocorre com a retirada da insulina ou a inibição da PI 3 quinase resulta da desfosforilação total de Thr412, com fosforilação residual remanescente em Thr252 refletindo a necessidade de (412/252) fosforilação dual para a atividade completa da quinase.
voltar |