FIGURA 10-4 FIGURA 10-4
Mecanismos da lesão tissular induzida pela hiperglicemia. Quatro hipóteses principais sobre como a hiperglicemia causa complicações do diabetes geraram dados abundantes, bem como vários estudos clínicos baseados em inibidores específicos desses mecanismos.
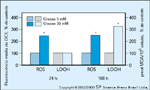 FIGURA 10-5 FIGURA 10-5
A hiperglicemia aumenta as espécies reativas de oxigênio (ERO) e a peroxidação lipídica (LOOH) intracelulares. Em células endoteliais aórticas, 30 mmol de glicose/L aumentou a formação de ERO (medida como diclorofluoresceína [DCF]) em 250% no período de 24 horas e a peroxidação lipídica resultante (medida como malondialdeído [MDA]) em 330% no período de 168 horas. Portanto, a hiperglicemia aumenta rapidamente a produção intracelular de ERO em células afetadas por complicações do diabetes. (Adaptado de Giardino et al. [4].)
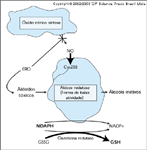 FIGURA 10-6 FIGURA 10-6
Função potencial da aldose redutase em células não-diabéticas. A enzima aldose redutase converte uma variedade de aldeídos tóxicos (como 2-oxo-aldeídos e aqueles derivados da peroxidação lipídica) em alcoóis inativos. A forma reduzida do fosfato de nicotinamida adenina dinucleotídeo (NADPH) é o cofator tanto nesta reação como na regeneração da glutationa pela glutationa redutase. Espécies reativas de oxigênio (ERO) parecem reduzir os níveis de óxido nítrico (NO). A atividade da aldose redutase é reversivelmente regulada para baixo ('downregulation') pela modificação pelo óxido nítrico de um resíduo de cisteína no sítio ativo da enzima. GSH — glutationa reduzida; GSSG — glutationa oxidada; NADP — fosfato de nicotinamida adenina dinucleotídeo, forma oxidada. (Adaptado de Chandra et al. [5], Pieper et al. [6] e King e Brownlee [7].)
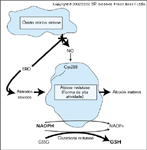 FIGURA 10-7 FIGURA 10-7
Função potencial da aldose redutase em células não-diabéticas sob estresse oxidativo. Em um ambiente euglicêmico, as espécies reativas de oxigênio (ERO) aumentam a concentração de aldeídos tóxicos. Ao mesmo tempo, os níveis de óxido nítrico (NO) são reduzidos, convertendo desta forma a aldose redutase em uma forma de alta atividade. Os níveis da glutationa não são afetados. GSH — glutationa reduzida; GSSG — glutationa oxidada; NADP — fosfato de nicotinamida adenina dinucleotídeo, forma oxidada; NADPH — fosfato de nicotinamida adenina dinucleotídeo, forma reduzida. (Adaptado de Chandra et al. [5], Pieper et al. [6] e King e Brownlee [7].)
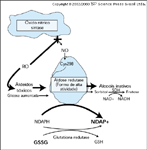 FIGURA 10-8 FIGURA 10-8
Função potencial da aldose redutase em células diabéticas. Em um ambiente hiperglicêmico, as espécies reativas de oxigênio (ERO) estão aumentadas, com as mesmas conseqüências descritas na Figura 10-7. Além disto, níveis aumentados de glicose intracelular resultam em aumento na conversão enzimática para poliálcool sorbitol e em reduções concomitantes nos níveis da forma reduzida do fosfato de nicotinamida adenina dinucleotídeo (NADPH) e glutationa. Em células nas quais a atividade da aldose redutase é suficiente para depletar a glutationa, o estresse oxidativo induzido pela hiperglicemia seria aumentado. O sorbitol é oxidado a frutose pela enzima sorbitol desidrogenase (SDH). GSH — glutationa reduzida; GSSG — glutationa oxidada; NAD — nicotinamida adenina dinucleotídeo; NADH — nicotinamida adenina dinucleotídeo, forma reduzida; NADP — fosfato de nicotinamida adenina dinucleotídeo. (Adaptado de Chandra et al. [5], Pieper et al. [6] e King e Brownlee [7].)
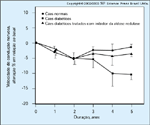 FIGURA 10-9 FIGURA 10-9
Efeito da inibição da aldose redutase sobre diminuições induzidas pelo diabetes na velocidade de condução nervosa. Em cães diabéticos, a condução tornou-se significativamente menor que o normal em 42 meses. A velocidade de condução em cães tratados com inibidores da aldose redutase permaneceu estatisticamente igual à normal durante todo o período de estudo de 5 anos. Em contraste, a inibição da aldose redutase não teve nenhum efeito sobre o desenvolvimento retinopatia diabética. (Adaptado de Engerman et al. [8].)
 FIGURA 10-10 FIGURA 10-10
Conseqüências potenciais da ativação da diacilglicerol-proteína quinase C induzida pela hiperglicemia. A hiperglicemia aumenta o conteúdo de diacilglicerol (DAG), em parte por síntese de novo e possivelmente também por hidrólise da fosfatidilcolina. DAG aumentado ativa a proteína quinase C (PKC), primariamente as formas beta e delta. A PKC ativada aumenta a produção de citocinas e matriz extracelular, do inibidor fibrinolítico PAI-1 e do vasoconstritor endotelina-1 (ET-1). A proteína quinase C é também um mediador da atividade do fator de crescimento endotelial vascular (VEGF). Estas alterações contribuiriam para o espessamento da membrana basal, oclusão vascular, permeabilidade aumentada e ativação da angiogênese. ANP — peptídio natriurético atrial; eNOS — óxido nítrico sintase endotelial;TGF — fator de transformação do crescimento. (Adaptado de Koya e King [9].)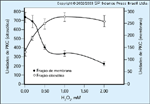 FIGURA 10-11 FIGURA 10-11
As espécies reativas de oxigênio (ERO) ativam a proteína quinase C (PKC) nas células endoteliais vasculares. À medida que aumenta o H2O2 produtor de ERO, ele ativa a PKC. O mecanismo parece envolver ativação direta ou indireta da fosfolipase D, que hidrolisa a fosfatidilcolina para produzir diacilglicerol (DAG). As espécies reativas de oxigênio também poderiam aumentar o DAG através de aumento da síntese de novo resultante da inibição por ERO da enzima gliceraldeído-3-fosfato desidrogenase. (Adaptado de Taher et al. [10] e Schuppe-Koistinen et al. [11].)
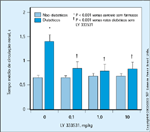 FIGURA 10-12 FIGURA 10-12
Melhora da disfunção vascular retiniana induzida pelo diabetes por um inibidor da proteína quinase C beta. Em ratos, o diabetes aumentou o tempo médio de circulação renal de 0,67 segundos para 1,40 segundos. Em pacientes diabéticos, o tratamento com a maior dose do inibidor da proteína quinase C beta, LY 333531, reduziu o tempo para 0,87 segundos. (Adaptado de Ishii et al. [12].)
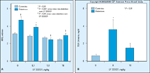 FIGURA 10-13 FIGURA 10-13
Melhora da disfunção renal induzida pelo diabetes por um inibidor da proteína quinase C (PKC) beta. Em ratos, o diabetes aumentou o ritmo de filtração glomerular (RFG) de uma média de 3,0 para 4,6 mL/min. Em pacientes diabéticos, o tratamento com a maior dose do inibidor da PKC beta, LY 333531, normalizou a RFG média (A). Similarmente, o diabetes aumentou a taxa de excreção de albumina em ratos de uma média de 1,6 para 11,7 mg/d. O tratamento de pacientes diabéticos com a maior dose de LY 333531 reduziu a taxa média de excreção de albumina para 4,9 mg/d (B). (Adaptado de Ishii et al. [12].)
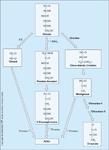 FIGURA 10-14 FIGURA 10-14
Vias potenciais que levam à formação de produtos finais da glicosilação avançada (AGEs – advanced glycation end products). Estes últimos podem originar da auto-oxidação de glicose a glioxal, decomposição do produto Amadori para 3-desoxiglicosona e fragmentação do gliceraldeído-3-fosfato para metilglioxal. Estas dicarbonilas reativas reagem com grupos amino de proteína para formar AGEs. Metilglioxal e glioxal são destoxificados pelo sistema da glioxalase. Todos os três precursores de AGE são também substratos de outras redutases. (Adaptado de Shinohara et al. [13] e Vander Jagt et al. [14])
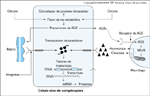 FIGURA 10-15 FIGURA 10-15
A produção intracelular de precursores de produto final de glicosilação avançada (AGE – advanced glycation end product) causa lesão em células-alvo por três mecanismos gerais. Primeiro, a glicosilação de proteína intracelular altera a função proteica. Segundo, a matriz extracelular modificada por precursores de AGE tem propriedades funcionais anormais.Terceiro, proteínas plasmáticas modificadas por precursores de AGE ligam-se aos receptores de AGE em células adjacentes, como macrófagos, induzindo assim a produção mediada pelo receptor de espécie reativa de oxigênio (ERO). Esta última, por sua vez, ativa o NFkB e a expressão de produtos gênicos patogênicos, inclusive citocinas e hormônios. mRNA — RNA mensageiro. (Adaptado de Brownlee [15].)
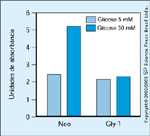 FIGURA 10-16 FIGURA 10-16
A glicosilação proteica intracelular pelo precursor de produto final de glicosilação avançada metilglioxal aumenta a endocitose macro-molecular em células endoteliais. Após uma exposição a 30 mmol de glicose/L, a endocitose macro-molecular por células endoteliais GM7373 que foram estavelmente transfectadas com o gene de resistência à neomicina (Neo) foi aumentada em 2,2 vezes. Em contraste, quando um maior acúmulo de metilglioxal foi enviado por uma expressão excessiva da enzima glioxalase I (Gly-1) nestas células, 30 mmol de glicose/L não aumentou a endocitose macromolecular. (Adaptado de Shinohara et al. [13].)
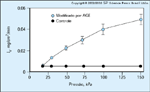 FIGURA 10-17 FIGURA 10-17
A membrana basal glomerular modificada por produtos finais da glicosilação avançada (AGEs – advanced glycation end products) tem uma maior permeabilidade à albumina. A ultrafiltração de albumina (Js) pela membrana basal glomerular modificada por AGE está significativamente aumentada em comparação com a ultrafiltração de albumina pela membrana basal glomerular não-modificada em uma faixa de diferentes pressões de filtração. (Adaptado de Cochrane e Robinson [16].)
 FIGURA 10-18 FIGURA 10-18
Proteínas de ligação a produto final de glicosilação avançada (AGE – advanced glycation end product) e supostos receptores. Foram identificadas cinco proteínas de ligação a AGE. 1) RAGE (receptor de AGE) é um novo membro da superfamília das imunoglobulinas; sua ligação gera espécies reativas de oxigênio e ativa o fator de transcrição pleiotrópico NFkB; 2) p60 exibe uma identidade de 95% com o OST-48, um componente do complexo oligossacariltransferase em membranas microssômicas; 3) p90 tem uma homologia significativa de seqüência com o 80K-H humano, um substrato da proteína quinase C; 4) galectina-3, uma proteína de ligação a carboidrato, também se liga a AGEs; 5) o receptor scavenger de macrófago de tipo II se liga aos AGEs e medeia sua captação por endocitose. RAGE — receptor de AGE. (Adaptado de Yan et al. [17], Li et al. [18],Vlassara et al. [19] e Araki et al. [20].)
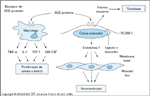 FIGURA 10-19 FIGURA 10-19
Os mecanismos pelos quais a ligação da proteína modificada por produto final de glicosilação avançada (AGE – advanced glycation end product) com os receptores específicos em macrófagos e células endoteliais podem causar alterações patológicas nos vasos sangüíneos diabéticos. Em macrófagos e células mesangiais, a ligação estimula a produção de fator-a de necrose tumoral (TNF), interleucina-1 (IL-1), fator-1 de crescimento semelhante à insulina (IGF-1) e fator de estimulação de colônias de granulócitos-macrófagos (GM-CSF) em níveis que aumentam a proliferação de células musculares lisas e aumentam a produção de matriz. Nas células endoteliais, a ligação induz alterações procoaguladoras na expressão gênica e maior expressão da molécula-1 de adesão vascular (VCAM-1) de ligação ao leucócito. (Adaptado de Brownlee [21].)
 FIGURA 10-20 FIGURA 10-20
Melhora das anormalidades em tecidos-alvo diabéticos por um inibidor de produto final de glicosilação avançada. Os efeitos deste inibidor (aminoguanidina) sobre anormalidades diabéticas foram investigados na retina, rim, nervo e artéria. Em animais experimentais, o desenvolvimento de todas as anormalidades patognomônicas examinadas foi inibido em 85% a 90%. Em um grande estudo randomizado, duplo-cego, controlado por placebo e multicêntrico de pacientes diabéticos tipo 1 com nefropatia patente, o tratamento com aminoguanidina reduziu a proteína urinária total e desacelerou a progressão da nefropatia. Além disto, a aminoguanidina reduziu a progressão da retinopatia diabética (Bolton et al., dados não-publicados). (Adaptado de Brownlee [15].)
voltar |