FIGURA 12-3 FIGURA 12-3
Diagnóstico de nefropatia diabética. A característica distintiva do diagnóstico de nefropatia diabética é a albuminúria. Microalbuminúria é o sinal clínico mais precocemente detectável de nefropatia diabética. Tipicamente, a microalbuminúria progride para proteinúria patente ao longo de um período de anos. A velocidade de progressão se baseia em inúmeros fatores, que são discutidos adiante neste capítulo. Além da microalbuminúria, os pacientes com nefropatia diabética inicial têm ritmos de filtração glomerular aumentados e seus rins sofrem hipertrofia. Portanto, clearance aumentado de creatinina e rim de tamanho aumentado são sinais adicionais de nefropatia diabética inicial. Existem associações nítidas entre nefropatia diabética e outros dois fatores importantes em termos diagnósticos: 1) a duração do diabetes e 2) retinopatia preexistente. É raro uma nefropatia diabética surgir em pacientes que tenham diabetes tipo 1 há menos de 5 anos. A maioria dos pacientes (até 90%) com nefropatia diabética também tem retinopatia [4]. Portanto, uma curta duração do diabetes ou ausência de evidências de retinopatia em um paciente com evidências de disfunção renal deve levar o clínico a considerar outras doenças renais.
 FIGURA 12-4 FIGURA 12-4
Motivos para considerar outras doenças renais em pacientes com diabetes mellitus. Se não houver albuminúria/proteinúria, então o paciente não terá nefropatia diabética. São listadas as considerações menos decisivas, mas ainda assim importantes, no diagnóstico de nefropatia diabética. O agravamento da função renal em um paciente com diabetes mellitus há menos de 5 anos deve instigar o médico a considerar outras causas de insuficiência renal. Tipicamente, ocorre redução no ritmo de filtração glomerular ao longo dos anos. Se um paciente apresentar clearance de creatinina decrescente ou creatinina sérica crescente que ocorre ao longo de semanas a meses, outras doenças renais deverão ser consideradas. A presença de um sedimento urinário ativo (ie, a presença de elementos como hemácias, leucócitos e cilindros hemáticos) deve levar o médico a considerar outras doenças renais. Embora a maioria dos pacientes com nefropatia diabética tenha um sedimento urinário relativamente inativo, até 25% a 30% dos pacientes com nefropatia diabética podem ter hematúria e, até, cilindros hemáticos [5]. O achado de um sedimento ativo, portanto, deve alertar o médico a considerar outras causas mas, por si só, pode não ser um motivo suficientemente forte para buscar evidências de outras causas renais.
 FIGURA 12-5 FIGURA 12-5
Detecção de albuminúria. A microalbuminúria é a marca registrada da nefropatia diabética inicial e, portanto, todos os pacientes diabéticos devem ser submetidos rotineiramente a uma triagem para a presença de microalbuminúria. Embora uma coleta cronometrada de urina seja uma maneira bem eficaz de se determinar a excreção de albumina com precisão, ela não é cômoda nem efetiva em termos de custo. Estudos recentes mostraram que a razão albumina/creatinina, obtida pela medição de albumina e creatinina em uma amostra pontual de urina, é um método altamente preciso para a triagem e acompanhamento de pacientes com diabetes mellitus [6]. Os dipsticks (hastes de medição) usados para a determinação de proteína na urina, porém, não são sensíveis o bastante para mensurar excreção proteica menor que 300 mg por 24 horas e, portanto, uma medição laboratorial direta de albumina é necessária para detectar microalbuminúria. Uma medição pontual e isolada de albumina é afetada pelo volume da urina, mas a normalização para a quantidade de creatinina na urina elimina este problema. Como mostrado, um valor de 30 mg/g é sugestivo da presença de microalbuminúria. Inúmeros estudos mostraram que a razão albumina/creatinina é um teste altamente preciso e eficaz para a detecção e acompanhamento de pacientes com diabetes mellitus. Na determinação da presença de microalbuminúria, as causas de aumentos transitórios na albuminúria devem ser considerados. A macroalbuminúria reflete uma nefropatia diabética progressiva. É necessário dar uma maior atenção ao tratamento (veja a Fig. 12-21). Portanto, medições repetidas de excreção de albumina são recomendadas antes de se rotular um paciente com um diagnóstico de nefropatia diabética inicial.
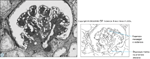 FIGURA 12-6 FIGURA 12-6
(Veja a Lâmina Colorida) Patologia da nefropatia diabética. Embora sejam típicas da nefropatia diabética são observadas na micrografia óptica (A) e na micrografia eletrônica (B) [7]. O Painel A mostra esclerose nodular, expansão mesangial e deposição hialina na arteríola aferente.
 FIGURA 12-6 (Continuação) FIGURA 12-6 (Continuação)
O Painel B mostra duas alças capilares. A alça capilar da direita mostra espessamento de membrana basal e expansão mesangial. Embora típicas da nefropatia diabética, estas alterações não são patognomônicas. Outras duas doenças também devem ser consideradas em um paciente com estes achados em biópsia renal: doença da deposição de cadeias leves e amilóide. É possível diferenciar estas doenças com colorações específicas e história. (Cortesia de Dr. Helmut Rennke, Boston, Massachusetts.)
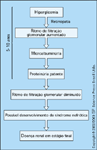 FIGURA 12-7 FIGURA 12-7
História natural da nefropatia diabética. Se um paciente com diabetes mellitus desenvolver microalbuminúria, a progressão para insuficiência renal tenderá a ser inexorável, a menos que sejam feitas intervenções específicas. Este esquema mostra a provável progressão em um paciente idealizado. Como anteriormente mencionado, a presença de microalbuminúria é a primeira evidência de detecção fácil e confiável da insuficiência renal. Um paciente que vai desenvolver insuficiência renal geralmente apresenta retinopatia detectável e exibirá evidências de insuficiência renal 5 a 10 anos após o diagnóstico de diabetes mellitus. Curiosamente, se o paciente não tiver desenvolvido proteinúria após 15 a 20 anos de diabetes, a probabilidade de desenvolver doença renal, com progressão de insuficiência renal, será bem reduzida [8]. Os motivos para progressão são multifatoriais. As figuras a seguir discutem as possíveis causas do desenvolvimento da nefropatia diabética e os motivos para a progressão da nefropatia diabética.
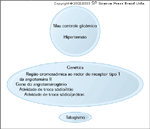 FIGURA 12-8 FIGURA 12-8
Fatores de risco para o desenvolvimento de nefropatia diabética. Foi demonstrado que o mau controle glicêmico e a hipertensão aumentam a probabilidade de desenvolvimento de nefropatia diabética [9]. Estes dois fatores estão independentemente correlacionados ao desenvolvimento da nefropatia diabética. Os pacientes com mau controle glicêmico também são mais propensos a ter hipertensão que os pacientes com um bom controle glicêmico [9]. Além disto, tem havido um esforço orquestrado no sentido de detectar genes específicos que predispõem os pacientes ao desenvolvimento de nefropatia diabética. A existência de tais genes é corroborada por vários achados. Uma história familiar de nefropatia diabética aumenta a probabilidade de desenvolvimento de nefropatia [10]. Além disto, certos grupos geneticamente semelhantes são mais suscetíveis à nefropatia que o são outros grupos. Por exemplo, membros da tribo de índios Pima do Arizona têm um alto índice de desenvolvimento de diabetes tipo 2 e, entre aqueles com mais de 45 anos de idade, 60% desenvolveram nefropatia, um percentual que é bem maior que a média [11]. Foi sugerido que os genes específicos listados nesta figura estariam associados ao desenvolvimento da nefropatia. Foi também demonstrado que o tabagismo, provavelmente por causa de seus efeitos deletérios sobre as células endoteliais vasculares, aumenta a probabilidade de desenvolvimento de nefropatia diabética em pacientes com diabetes mellitus tipo 1 e tipo 2 [12].
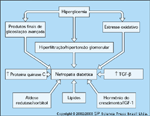 FIGURA 12-9 FIGURA 12-9
Mecanismos sugeridos subjacentes ao desenvolvimento e progressão da nefropatia diabética. Vários mecanismos foram propostos como responsáveis pelo desenvolvimento de nefropatia diabética. Nenhum deles são mutuamente exclusivos e é provável que as interações entre muitos destes fatores contribuam para a nefropatia diabética. Uma compreensão destes mecanismos é essencial para que possam ser produzidas terapias apropriadas para prevenir o desenvolvimento e a progressão da nefropatia diabética. Várias terapias existentes, bem como tratamentos atualmente em desenvolvimento ou em estudos clínicos, baseiam-se na alteração de um ou mais dos mecanismos mostrados nesta figura. As próximas figuras fornecem uma breve revisão de cada um destes mecanismos. IGF-1 — fator de crescimento semelhante à insulina;TGF-b — fator beta de transformação do crescimento.
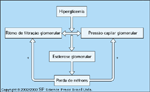 FIGURA 12-10 FIGURA 12-10
Hiperfiltração glomerular. A hiperfiltração glomerular é uma característica distintiva da nefropatia diabética. Ritmos de filtração glomerular (RFG) maiores ou iguais a 150 mL/min são observados na nefropatia diabética inicial. Zatz et al. [13] foram os primeiros a demonstrar que uma intervenção direcionada para a redução da hiperfiltração desacelerava significativamente a progressão da nefropatia diabética em ratos. A hipótese é que a RFG está associada a uma maior pressão no tufo capilar glomerular. Esta hipertensão glomerular leva então à esclerose glomerular e perda de néfrons funcionantes. Embora a taxa de filtração glomerular total diminua quando néfrons suficientes sofrem esclerose, a hipótese sugere que a filtração e, portanto, a pressão nos glomérulos funcionantes remanescentes serão altas porque a carga filtrada que chega ao rim será igual à que chegava quando havia mais glomérulos funcionantes. Muitas pesquisas corroboram esta hipótese geral. Um ponto mais importante é que os esforços de se usar intervenções que levam especificamente a uma redução na pressão capilar glomerular são agora os sustentáculos do tratamento da nefropatia diabética (eg, inibidores da enzima conversora da angiotensina, bloqueadores do receptor da angiotensina e dietas pobres em proteína). Uma extensão desta hipótese foi recentemente sugerida por Brenner e Mackenzie [14], que propuseram que um dos fatores predisponentes para a progressão da doença renal e possivelmente para o desenvolvimento da nefropatia diabética seria o número de glomérulos com que cada pessoa nasce. Isto é, a presença de menos glomérulos levaria a uma relativa hiperfiltração/hipertensão glomerular, que levaria lentamente à insuficiência renal. Esta hipótese ainda é controversa.
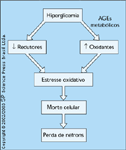 FIGURA 12-11 FIGURA 12-11
Estresse oxidativo. Muitos estudos em seres humanos e em animais determinaram que pacientes com diabetes têm evidências de maior estresse oxidativo [15]. Os oxidantes intracelulares podem aumentar como resultado da produção intracelular de oxidantes ou pela exposição a oxidantes extracelulares. A célula regula cuidadosamente o nível de oxidantes intracelulares por uma série de enzimas que reduzem os oxidantes. Defeitos nas ações destas enzimas também contribuiriam para um nível excessivo de oxidantes intracelulares. A hiperglicemia sozinha pode aumentar o nível de oxidantes intracelulares. Níveis aumentados de oxidantes podem causar defeitos em vários eventos intracelulares e causar morte celular. Além disto, níveis aumentados de oxidantes levam a uma atividade aumentada da proteína quinase C, ligando desta maneira os dois mecanismos fisiopatológicos. Inúmeros estudos atualmente em andamento têm como objetivo determinar se antioxidantes, como a vitamina E, têm um papel terapêutico no tratamento da nefropatia diabética. AGE — advanced glycation end products [produtos finais da glicosilação avançada].
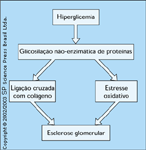 FIGURA 12-12 FIGURA 12-12
Produtos finais da glicosilação avançada. Os produtos finais da glicosilação avançada (AGEs – advanced glycation end products) são proteínas que reagiram não-enzimaticamente com a glicose. Embora eles existam normalmente, o número de AGEs aumenta significativamente em pacientes com nefropatia diabética. Os AGEs foram implicados no desenvolvimento de complicações do diabetes [16]. Em particular, a produção de AGE leva a um maior estresse oxidativo. Os AGEs também podem provocar ligação cruzada com colágeno e, por se ligarem a receptores específicos, podem levar a aumentos intracelulares nos oxidantes. A administração de AGEs em animais pode causar várias alterações que são observadas em animais com diabetes, inclusive esclerose glomerular [17]. O acúmulo de AGEs ocorre paralelamente à gravidade da nefropatia diabética [18]. Atualmente, existem vários estudos clínicos em andamento que utilizam um inibidor da formação de AGEs, a aminoguanidina, para determinar se este fármaco pode ajudar os pacientes com nefropatia estabelecida e também ajudar a prevenir a nefropatia diabética.
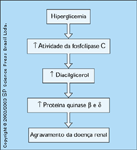 FIGURA 12-13 FIGURA 12-13
Proteína quinase C. A proteína quinase C (PKC) é uma serina/treonina quinase que comprovadamente desempenha papéis importantes no crescimento celular normal, no crescimento de células cancerosas e em vários outros processos intracelulares. O trabalho de Koya e King [19] mostrou que a hiperglicemia leva à ativação da PKC. Um trabalho mais detalhado demonstrou que isoformas específicas da PKC são especificamente ativadas pela hiperglicemia. A prevenção da ativação da PKC pode reduzir a expansão mesangial e prevenir a progressão da doença renal. Os efeitos deletérios da PKC sobre o rim podem ser o resultado da estimulação da produção da citocina 'fator-b de transformação do crescimento' (TGF-b) (veja a Fig. 12-14). Em particular, foi sugerido que a PKC b desempenharia um papel fisiopatológico importante no desenvolvimento de complicações vasculares, retinianas e outras complicações do diabetes mellitus. Ishii et al. [20] mostraram em ratos diabéticos que um inibidor que bloqueia especificamente a PKC reduziu enormemente o aumento na TGF-b renal e também reduziu o aumento de outras proteínas associadas à esclerose. Isto sugere que inibidores da PKC podem desempenhar um importante papel nos futuros tratamentos da nefropatia diabética.
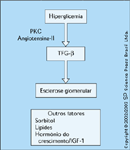 FIGURA 12-14 FIGURA 12-14
Fator-b de transformação do crescimento. O fator-b de transformação do crescimento (TGF-b) é uma citocina que pode estimular algumas células a crescer e inibir o crescimento de outras células. Ziyadeh et al. [21] forneceram um vigoroso corpo de dados que corrobora a hipótese de que o TGF-b é um importante mediador das lesões encontradas na nefropatia diabética. A sugestão de que o TGF-b desempenha um papel na patogênese da nefropatia diabética é confirmada pelas seguintes evidências: 1) pacientes com nefropatia diabética têm níveis aumentados de TGF-b; 2) o TGF-b pode causar esclerose glomerular em modelos animais de nefropatia diabética; e 3) anticorpos neutralizantes contra TGF-b preveniram o desenvolvimento da nefropatia diabética em um modelo animal. Uma especulação interessante é que um aumento da atividade da proteína quinase C (PKC) leva a uma maior expressão de TGF-b. Logo, a hiperglicemia poderia ser o ponto de iniciação que leva a um aumento de estresse oxidativo, que leva a um aumento da atividade da PKC, que leva a um aumento da expressão de TGF-b. Além disto, a hiperglicemia leva à produção de produtos finais da glicosilação avançada. Portanto, todos estes mecanismos, separadamente e em conjunto, contribuem para o desenvolvimento e a progressão da nefropatia diabética. Outros fatores também foram implicados. A atividade da aldose redutase e a produção de sorbitol foram implicadas na nefropatia diabética. O sorbitol é produzido pela redução da glicose pela aldose redutase. O sorbitol é osmoticamente ativo e, conseqüentemente, um aumento de sorbitol pode levar ao intumescimento celular e morte celular. Além disto, a ação da aldose redutase leva à perda de antioxidantes intracelulares, aumentado desta maneira o estresse oxidativo. Embora o aumento da atividade da aldose redutase pareça desempenhar um papel significativo na patogênese da neuropatia diabética, ainda resta ser demonstrado se ele exerce um papel importante na nefropatia diabética. Estudos epidemiológicos implicaram lípides aumentados como possíveis mediadores. Embora pareça evidente que lípides aumentados estão associados à progressão da nefropatia diabética, o mecanismo subjacente a esta associação não foi bem definido. A importante associação do agravamento da doença vascular com lípides aumentados pode ser o mecanismo pelo qual os lípides contribuem para a progressão da nefropatia diabética. Por fim, um corpo crescente de pesquisa sugere que o hormônio do crescimento/fator-1 de crescimento semelhante à insulina (IGF-1) possa ter um papel importante na patogênese da nefropatia diabética. Um estudo revelou uma forte correlação positiva entre níveis urinários de hormônio do crescimento e IGF-1 com o desenvolvimento de microalbuminúria e rim de tamanho aumentado em pacientes com diabetes mellitus tipo 1 [21].
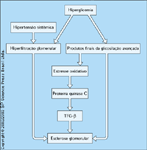 FIGURA 12-15 FIGURA 12-15
Possíveis conexões entre os vários mecanismos que podem contribuir para a nefropatia diabética. Este modelo sugere que o controle do açúcar no sangue é de suprema importância. A pesquisa do Diabetes Control and Complications Trial (DCCT) apóia fortemente esta idéia [22]. Ainda assim, mesmo depois de haver evidências de nefropatia diabética, muitos destes mecanismos poderão ocorrer independentemente (até certo ponto) do atual controle da glicose no sangue. Por exemplo, se tiver ocorrido perda de néfrons, então a hiperfiltração/hipertensão glomerular continuará mesmo na presença de um rígido controle do açúcar no sangue. Outros mecanismos mostrados na figura também podem se tornar um tanto autônomos depois de efetivada a lesão inicial ao glomérulo. Portanto, um rígido controle do açúcar no sangue, bem como outras intervenções que bloqueiam os mecanismos mostrados nesta figura, são provavelmente necessários para evitar a progressão da nefropatia diabética.TGF-b — fator beta de transformação do crescimento.
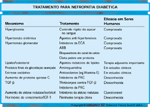 FIGURA 12-16 FIGURA 12-16
A eficácia em seres humanos dos vários tratamentos para nefropatia diabética, listada de acordo com o mecanismo. Como anteriormente observado, uma abordagem terapêutica mista é provavelmente a mais benéfica. ECA — enzima conversora da angiotensina; ARB — angiotensin-receptor blockers ; IGF — fator de crescimento semelhante à insulina; PKC — proteína quinase C;TGF — fator de transformação do crescimento.
voltar |