  FIGURA 14-6 FIGURA 14-6
Síndrome de Cushing. A síndrome de Cushing é uma causa endócrina comum de intolerância à glicose e diabetes secundários. A homeostase anormal da glicose pode resultar da administração exógena diária ou em dias alternados de glicocorticóides ou como conseqüência de excesso endógeno crônico de glicocorticóides causado por hipersecreção hipofisária do hormônio adrenocorticotrófico (ACTH), produção paraneoplásica de ACTH por células tumorais, ou hiperfunção autônoma de córtex adrenal. Esta última afetou esta paciente, fotografada antes (A) e depois (B) da apresentação com síndrome de Cushing fenotípica. Foi constatado que a paciente tinha um adenoma de córtex adrenal.
Embora hiperglicemia de jejum ocorra em aproximadamente 5% dos pacientes com síndrome de Cushing, a resistência à insulina com hiperinsulinemia basal ou estimulada ocorre em até 90% dos pacientes. Os pacientes com síndrome de Cushing podem se apresentar em um estado hiperosmolar, não-cetótico [1]. Esta apresentação é extremamente rara em pacientes com acromegalia, que, por outro lado, exibem um espectro de perfis anormais de glicose e insulina semelhantes àqueles de pacientes com a síndrome de Cushing. (Cortesia de Jaishree Jagirdar, Escola de Medicina da Universidade de Nova York, Nova York.) 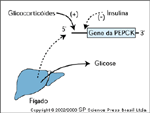 FIGURA 14-7 FIGURA 14-7
O excesso de glicocorticóide promove produção hepática de glicose. Várias enzimas-chaves que controlam a produção e a utilização de combustíveis metabólicos são diretamente reguladas por glicocorticóides no nível da transcrição gênica. A fosfoenolpiruvato carboxiquinase (PEPCK), uma enzima crucial na neoglicogênese, é regulada positivamente por glicocorticóides [10]. De fato, camundongos transgênicos que superexpressam PEPCK exibem tolerância à glicose diminuída [11]. Além disto, a exposição de ratas prenhas à glicocorticóide em excesso, no final da gestação, aumenta permanentemente a expressão hepática de PEPCK e receptor de glicocorticóide e causa intolerância à glicose nos descendentes adultos [12]. Sob condições fisiológicas normais, contudo, a insulina regula PEPCK de forma mais potente e dominante, de uma maneira negativa [13]. Portanto, insulina farta previne a neoglicogênese aumentada que seria causada por excesso de glicocorticóide. Na presença de deficiência de insulina ou de comprometimento da ação da insulina, porém, os efeitos estimulantes dos glicocorticóides sobre a produção de glicose tornam-se aparentes. Já que os pacientes com Síndrome de Cushing quase sempre apresentam resistência à insulina, o palco fica preparado para a neoglicogênese amplificada por glicocorticóide, que contribui para a intolerância à glicose.
 FIGURA 14-8 FIGURA 14-8
Glicocorticóide em excesso diminui a utilização periférica de glicose. Os glicocorticóides induzem a captação de glicose estimulada por resistência à insulina em adipócitos de rato [14]. Este efeito pode ser, pelo menos em parte, mediado pela inibição direta por glicocorticóide da translocação induzida pela insulina da proteína quinase C, do citosol para a membrana plasmática. Os glicocorticóides também inibem a ativação do transporte de glicose em músculo esquelético de rato pela insulina, fator-1 de crescimento semelhante à insulina e hipóxia [15]. No músculo soleus de rato, este efeito está associado à preservação do conteúdo total dos transportadores de glicose GLUT4, mas também à menor translocação de unidades do transportador GLUT4 até a membrana plasmática [16]. Além destes efeitos sobre o tráfego subcelular de GLUT4, os glicocorticóides afetam as etapas iniciais da sinalização do receptor de insulina no músculo esquelético e no fígado [17]. Conseqüentemente, a captação e a utilização de glicose, tanto basais quanto estimuladas pela insulina, estão sujeitas à modulação pelos glicocorticóides em excesso.
 FIGURA 14-9 FIGURA 14-9
Os glicocorticóides inibem a secreção de insulina das células b pancreáticas. A resistência à insulina é reconhecida há muito tempo como uma conseqüência do excesso de glicocorticóide. Os efeitos dos glicocorticóides sobre a secreção de insulina in vivo e in vitro, contudo, só foram descritos recentemente. Camundongos transgênicos superexpressando o receptor de glicocorticóide (GR – glucocorticoid receptor) sob o controle do promotor da insulina aumentaram a sensibilidade ao glicocorticóide que está restrita às células b pancreáticas [18]. Estes animais têm níveis normais de glicose sangüínea em jejum e pós-absortiva, mas também têm uma resposta de insulina acentuadamente reduzida e tolerância à glicose diminuída durante uma carga de glicose intravenosa. Esta evidência in vivo que sugere um efeito diabetogênico dos glicocorticóides sobre as células b pancreáticas é corroborada por evidências in vitro de degradação pós-tradução induzida por dexametasona dos transportadores de glicose GLUT2 de células b [19] e de inibição induzida pela dexametasona da liberação exocítica de insulina das ilhotas de roedores em cultura [20]. Uma utilização diminuída de glicose na síndrome de Cushing pode, portanto, ser um resultado composto de secreção deficiente de insulina e comprometimento da ação da insulina.
voltar |