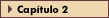FIGURA 15-6 FIGURA 15-6
Requisito para um peso estável. Um peso estável exige uma equivalência entre calorias ingeridas e calorias gastas. A massa livre de gordura é um importante determinante de gasto de energia em repouso [6]. O ganho de peso leva a um aumento tanto na massa gordurosa quanto na massa livre de gordura; portanto, a taxa metabólica basal de pessoas obesas é maior que a de pessoas magras da mesma altura [7]. A obesidade resulta do excesso crônico de calorias ingeridas em relação às calorias gastas. As calorias gastas incluem a taxa metabólica em repouso, os efeitos térmicos do alimento e exercícios e a termogênese adaptativa. A gordura corpórea não é significativamente influenciada pelo gasto de energia em repouso nem pelo efeito térmico do alimento [8], mas alterações no gasto de energia resultante de atividade física influenciam o peso e a composição corpórea [9].
 FIGURA 15-7 FIGURA 15-7
Homeostase de energia. Durante muitos anos, a obesidade foi considerada a conseqüência de um defeito moral. Comer era considerado um processo inteiramente sob o controle voluntário e gasto reduzido de energia era atribuído à inatividade. Com o tempo, diversos estudos revelaram que a termogênese variava entre as pessoas e que, quando colocada em dietas compostas de calorias iguais, as pessoas poderiam ganhar, manter ou até perder peso. A descoberta da leptina em 1994 revolucionou a compreensão da base fisiopatológica da obesidade. É agora evidente que vários fatores regulam o apetite e o gasto total de energia. A demonstração de que defeitos gênicos únicos podem levar à obesidade também demonstrou que a alimentação excessiva é um processo que nem sempre é acessível ao controle consciente.
 FIGURA 15-8 FIGURA 15-8
Organização hipotalâmica. O papel do hipotálamo na regulação do comportamento alimentar foi inicialmente definido há décadas em estudos de estimulação elétrica e lesões anatômicas. O papel do hipotálamo lateral na mediação da alimentação foi considerado pela primeira vez em 1951 [10]. Em 1940, foi relatado que lesões hipotalâmicas experimentais do hipotálamo ventromedial produziam obesidade [11].
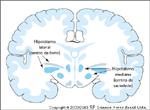 FIGURA 15-9 FIGURA 15-9
Áreas hipotalâmicas implicadas no comportamento alimentar. O hipotálamo lateral é verde (a área em verde mais claro indica a zona incerta). O hormônio concentrador de melanina [12] e a orexina [13] situam-se nesta área e estimulam a fome. O hipotálamo mediano (ventromedial e dorso-medial) é vermelho e o núcleo paraventricular é amarelo. O núcleo arqueado, onde estão localizados os corpos celulares que produzem o neuropeptídio Y, a preproopiomelanocortina (o precursor do hormônio que estimula melanócitos), o peptídio relacionado a agouti e o transcrito regulado por cocaína e anfetamina [CART – cocaine- and amphetamine-regulated transcript], é rosa. O neuropeptídio Y e o peptídio relacionado ao agouti estimulam a ingestão alimentar e o hormônio estimulador de melanócitos e o CART inibem a ingestão alimentar.
As monoaminas também desempenham um papel na regulação do apetite. Em animais experimentais, a administração de noradrenalina leva a um aumento agudo na ingestão de alimento e a administração crônica leva ao ganho de peso. Este efeito parece ser dependente do receptor estimulado porque os agonistas a2 aumentam a ingestão de alimento enquanto os agonistas a1 e b2 levam a uma redução na ingestão alimentar [14-16]. A dopamina desempenha um papel importante na regulação da ingestão alimentar; entretanto, os efeitos dependem do lugar em que ela é liberada. A administração de dopamina no hipotálamo lateral leva a uma refeição de menor tamanho [17] enquanto a liberação no núcleo accumbens aumenta a ingestão de alimento [18]. A serotonina também afeta a ingestão de alimentos; entretanto, os efeitos são complexos e variam dependendo de qual área anatômica do cérebro é o alvo e do receptor ativado. 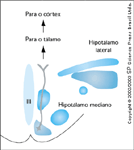 FIGURA 15-10 FIGURA 15-10
Neuropeptídio Y. O neuropeptídio Y (NPY) é produzido nos neurônios do núcleo arqueado. O papel do NPY na alimentação é atribuído a projeções diretas do NPY ao núcleo paraventricular [19]. Injeções repetitivas de NPY no hipotálamo induz hiperfagia e obesidade [20]. O neuropeptídio Y também altera o metabolismo de energia. Depois de repetidas injeções de NPY, a atividade termogênica da gordura castanha está diminuída e a atividade da lipoproteína lipase da gordura branca está diminuída [21]. Este achado sugere que os neuropeptídios que regulam o apetite podem ter múltiplos papéis.
Uma das ações da leptina é a supressão da síntese de NPY no núcleo arqueado. Este peptídio parece funcionar como um importante regulador central do comportamento alimentar. A injeção de NPY nos ventrículos laterais de rato leva a um acentuado aumento na alimentação; animais tratados com NPY comem seis a dez vezes mais que animais controle durante o período de 24 horas seguintes. Injeções repetidas durante vários dias causam ganho de peso. O neuropeptídio Y também suprime o gasto de energia através de ações sobre o sistema nervoso simpático. Embora o NPY seja difusamente expresso, são os neurônios sintetizadores de NPY do núcleo arqueado que se projetam para o núcleo paraventricular e o hipotálamo dorsomediano que são responsáveis pela mediação do comportamento alimentar. No camundongo ob/ob, os níveis de RNA mensageiro (mRNA) no núcleo arqueado são duas a três vezes maiores que os níveis de mRNA nos camundongos controle; os níveis do peptídio estão também aumentados no camundongo ob/ob. Resultados semelhantes são encontrados no rato Zucker gordos. Tanto o tratamento intracerebroventricular central quanto o periférico com leptina de animais ob/ob reduziram as mensagens de NPY no núcleo arqueado, sugerindo que o NPY seja um alvo da leptina. Em animais normais, a administração periférica de leptina inibe significativamente o aumento nos níveis de mRNA de NPY do arqueado observados com a inanição. Embora o NPY possa normalmente mediar o comportamento alimentar, camundongos com knockout de NPY nos quais o NPY está ausente de todos os tecidos não apresentam alterações demonstráveis no comportamento alimentar. O cruzamento reprodutivo entre camundongos com knockout de NPY e camundongos ob/ob revelou que a prole com duplo knockout tinha um fenótipo atenuado de obesidade. Estes dados indicam que o NPY é um regulador importante, mas não exclusivo, do comportamento alimentar e gasto de energia.  FIGURA 15-11 FIGURA 15-11
Vários fatores periféricos que contribuem para o apetite podem agir sobre as ações cerebrais [22]. Foi constatado que a grelina, que é sintetizada no estômago, desempenha um papel na iniciação da refeição, possivelmente através de ações em neurônios-alvo no hipotálamo [23,24]. O peptídio YY é sintetizado no intestino e tem um efeito orexigênico através da ação no cérebro [25]. Agentes anoréticos também podem ser produzidos pelo intestino. O peptídio-1 semelhante ao glucagon (GLP-1) é sintetizado no intestino e age para suprimir o apetite em animais e seres humanos [26]. A colecistocinina (CCK), que é produzida nas células endócrinas, também age no sentido de inibir o apetite [27]. Finalmente, a insulina, que é produzida no pâncreas em resposta às refeições, pode também agir no cérebro para regular a ingestão de alimentos e gasto de energia [28]. GR — receptor de grelina; LR — receptor de leptina. voltar
|