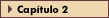FIGURA 15-12 FIGURA 15-12
Causas monogênicas de obesidade em roedores. A identificação de causas monogênicas de ocorrência espontânea da obesidade ofereceu pistas significativas para compreender a regulação do peso corpóreo. A identificação do hormônio de gordura, a leptina [29], forneceu um mecanismo pelo qual a gordura pode sinalizar o estado dos depósitos periféricos de energia ao cérebro [30]. A leptina é também importante na regulação de respostas fisiológicas ao jejum [31]. A análise de outros modelos de obesidade, como o camundongo Ay, forneceu um insight significativo das vias que são importantes na regulação do peso corpóreo. Modelos de engenharia têm sido importantes na confirmação da importância das vias e na identificação dos papéis dos diferentes peptídios. AgRP — agouti-related peptide [peptídio relacionado ao agouti; CRH — hormônio liberador da corticotrofina; NPY — neuropeptídio Y.
 FIGURA 15-13 FIGURA 15-13
Causas monogênicas da obesidade humana. Peptídios-chaves identificados em camundongos levaram à busca de pacientes com defeitos semelhantes. Estes estudos foram feitos em pacientes com obesidade mórbida de início bem precoce. Em muitos casos (como deficiência de leptina, deficiência do receptor de leptina, anormalidades do receptor de melanocortina e mutações de PC-1), o fenótipo humano é semelhante ao fenótipo de roedor. Algumas mutações, porém, como as mutações no gene POMC e as mutações em PPARg2, só foram descritas em seres humanos.
 FIGURA 15-14 FIGURA 15-14
Causas monogênicas de magreza em roedores. A maioria das causas monogênicas da magreza de roedores foram lesões especificamente criadas por engenharia. O mecanismo pelo qual algumas dessas manipulações causam magreza é compreendido, como na superexpressão hepática de leptina e deficiência do hormônio concentrador de melanina [32]. Em outros casos, porém, como no knockout de proteína quinase A, não se conhece o mecanismo de magreza. É digno de nota que a ablação do gene NPY em roedores não causou magreza nem quaisquer alterações no fenótipo de alimentação [33]. Entretanto, a ausência do neuropeptídio Y levou a uma atenuação da obesidade encontrada no camundongo Lep ob /Lep ob [34]. As causas monogênicas da magreza humana não foram identificadas pois a busca de tais mutações seria complicada. A definição de critérios para a triagem de famílias apropriadas seria difícil porque os pesos, embora reduzidos, poderiam ainda estar dentro da faixa normal.
 FIGURA 15-15 FIGURA 15-15
Lista parcial de peptídios que regulam a ingestão alimentar. Sabe-se que vários peptídios estimulam a ingestão alimentar e que muitos mais a suprimem. Além disto, a ingestão alimentar é regulada por monoaminas (não discutidas aqui). CART — cocaine- and amphetamine-regulated transcript [transcrito regulado por cocaína e anfetamina].
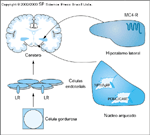 FIGURA 15-16 FIGURA 15-16
Sítios de lesões de um único gene que levam à obesidade humana. As relações entre peptídios envolvidos na regulação da alimentação são complexas. Esta figura sintetiza algumas das interações conhecidas. A leptina é sintetizada por adipócitos e liberada na circulação. O transporte de leptina através da barreira hematoencefálica é mediado pela forma curta do receptor da leptina (LR). No cérebro, a leptina tem como alvo os receptores de forma longa [35] tanto no hipotálamo arqueado como no dorsomediano (não mostrado). No hipotálamo arqueado, a leptina regula os corpos celulares que co-expressam o peptídio relacionado ao agouti (AgRP) e o neuropeptídio Y (NPY) (peptídios que estimulam a alimentação) e células que coexpressam a preproopiomelanocortina (POMC, o precursor do hormônio estimulante de melanócitos) e o transcrito regulado por cocaína e anfetamina (CART – cocaine- and amphetamine-regulated transcript) (peptídios que inibem a alimentação). As células do arqueado projetam-se para várias áreas, inclusive o hipotálamo lateral [36], onde o receptor da melanocortina-4 (MC4-R) [37], que responde à POMC e ao AgRP, é expresso. Este receptor pode estar presente em neurônios que expressam a orexina ou o hormônio concentrador da melanina, embora esta localização ainda não tenha sido confirmada.
 FIGURA 15-17 FIGURA 15-17
A deficiência de leptina causa a síndrome da obesidade encontrada nos camundongos ob/ob. Estes camundongos desenvolvem obesidade precoce associada à hiperfagia e resistência à insulina. A deficiência de leptina foi descrita em duas crianças aparentadas. Ambas tiveram peso normal ao nascer, mas eram acentuadamente obesas durante a primeira infância. O eixo hipotálamo-hipófise-adrenal (HHA) era normal nestas crianças, embora o nível do hormônio estimulante da tireóide (TSH) estivesse ligeiramente elevada. Nas duas crianças, o controle glicêmico era normal; este achado difere da grave resistência à insulina encontrada em camundongos. Os dois pares de pais eram de peso normal. A análise do gene da leptina revelou que os pais eram heterozigóticos e que as crianças eram homozigóticas para uma mutação de deslocamento de quadro de leitura ('frameshift mutation') que levou à síntese de espécies truncadas, não-secretadas [38].
 FIGURA 15-18 FIGURA 15-18
Mutação em receptor de leptina humano. A deficiência de receptor da leptina foi descrita em uma família grande [39]. O probando (caso índice) apresentou-se com obesidade e hipogonadismo hipogonadotrófico significativos. Os homozigotos afetados têm níveis de leptina aumentados 100 vezes (índice de massa corpórea [IMC]) a mais que o conteúdo gorduroso. Os heterozigotos afetados tinham IMCs na faixa pré-obesa ou minimamente obesa e níveis de leptina de aproximadamente 200 mg/mL.TSH - nível do hormônio estimulante da tireóide.  FIGURA 15-19 FIGURA 15-19
Peptídios envolvidos na regulação do comportamento alimentar e pigmentação. A intrigante conexão entre pigmentação e alimentação foi sugerida pela primeira vez pelo achado que camundongos amarelos espontaneamente mutantes (Ay), conhecidos como camundongos agouti, também eram acentuadamente obesos. O agouti (normalmente expresso na pele) age sobre os melanócitos como um fator parácrino para inibir a conversão de ficomelanina (amarelo) em eumelanina (preto). A maioria dos camundongos é castanha por causa de misturas variáveis destes dois pigmentos. Os camundongos Ay expressam agouti em todos os tecidos e de uma forma desregulada. Estes achados sugeriram que os receptores de melanocortina têm um papel na mediação do comportamento alimentar.
A proteína agouti é expressa na pele e regula a coloração da pele, agindo através do receptor-1 da melacortina, onde inibe a ação do hormônio estimulante de melanócitos; quando universalmente expressa, leva à pigmentação amarela (inibindo o receptor da melacortina-1) e à obesidade por inibir os receptores de melanocortina-2 expressos centralmente. Estes receptores são expressos no sistema nervoso central; quando ativados pelo hormônio estimulante de melanócitos, medeiam a inibição do comportamento alimentar [40]. O hormônio concentrador da melanina regula a pigmentação cutânea em peixes, é produzido na hipófise e liberado na circulação e age sobre melanóforos (células contendo grânulos de pigmento) para causar agregação de grânulos e escurecimento cutâneo. Não tem nenhum papel conhecido na pigmentação de mamíferos, mas, nos mamíferos, é produzido no hipotálamo lateral; estimula o comportamento alimentar através de um receptor ainda não identificado. Um ligante antagonista endógeno potencial para os receptores de melanocortina hipotalâmica é a proteína relacionada ao agouti, um homólogo recentemente clonado do agouti. Esta proteína é expressa no núcleo arqueado do hipotálamo e seu RNA mensageiro é regulado para cima ('up-regulated') tanto nos camundongos ob/ob como nos db/db. A proteína relacionada ao agouti parece inibir o receptor de melanocortina de uma maneira semelhante à do agouti.  FIGURA 15-20 FIGURA 15-20
O camundongo Ay, no qual a proteína agouti normal é expressa ectopicamente, é amarelo e obeso [41].
 FIGURA 15-21 FIGURA 15-21
Proteína agouti. A proteína agouti é normalmente expressa nos folículos pilosos da pele e regula a pigmentação da pele e pelagem. A proteína agouti expressa perifericamente inibe o receptor da melanocortina-1 (MC1-R) e impede a conversão do pigmento amarelo para o pigmento preto mediada pelo hormônio estimulante de melanócitos (MSH) [42]. Se for produzido na hipófise, o MSH regulará a pigmentação; se produzido no hipotálamo, regulará a fome.
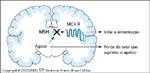 FIGURA 15-22 FIGURA 15-22
Proteína agouti. A proteína agouti (Ay) centralmente expressa age no receptor melanocortina-4 (MC4-R) [43] e impede a inibição da alimentação mediada pelo hormônio estimulante de melanócitos (MSH). A síndrome da obesidade poderia ser mimetizada pela obtenção por engenharia genética de um camundongo no qual MC4-R estivesse ausente [44]; esta capacidade demonstra a importância deste receptor. No camundongo Ay, o agouti é expresso no cérebro. O agouti bloqueia o MC4-R, um dos dois receptores cerebrais de melanocortina. O MC4-R não é capaz de responder ao a-MSH. Os efeitos inibitórios do a-MSH sobre a fome foram perdidos; portanto, o camundongo Ay é obeso.
 FIGURA 15-23 FIGURA 15-23
Expressão do agouti e peptídio relacionado ao agouti (AgRP). Por não ser o agouti normalmente expresso no sistema nervoso central, o achado do efeito do agouti sobre os receptores de melanocortina centralmente expressos levou a uma busca de peptídios semelhantes ao agouti no sistema nervoso central. O peptídio relacionado ao agouti [45,46] é expresso no núcleo arqueado e é um dos peptídios do sistema nervoso central que regulam o receptor da melacortina-4 (MC4-R). Além disto, as atenções se concentraram sobre o hormônio estimulante de melanócitos-a (MSH), um produto da preproopiomelanocortina no arqueado, e sobre o papel do a-MSH na regulação da alimentação por agir como um agonista no MC4-R.
 FIGURA 15-24 FIGURA 15-24
Mutações no receptor da melacortina-4 (MC4-R). Uma coorte de crianças gravemente obesas foi submetida à triagem de mutações no MC4-R por meio de seqüenciamento direto de nucleotídeos [47]. Um paciente era heterozigótico para uma deleção de 4 pares de base no códon 211 do MC4-R. Esta mutação resultou em um códon de parada ('stop codon') na região que codifica o quinto domínio transmembranar. Os resíduos no quinto e sexto domínio transmembranar são importantes para a sinalização do MC4-R e, portanto, esta mutação resulta em um receptor não-funcional. A mãe do probando tem peso normal, mas o pai é obeso (índice de massa corpórea, 41). A mesma mutação foi identificada no pai.
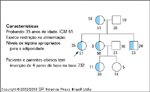 FIGURA 15-25 FIGURA 15-25
Mutações de deslocamento de quadro de leitura ('frameshift mutations') do receptor da melanocortina-4 receptor (MC4-R) e obesidade humana herdada dominantemente. Uma população francesa foi submetida a triagem através da seleção de pessoas com uma história de obesidade na primeira infância e o maior índice de massa corpórea (IMC) de toda a vida, em qualquer dada idade [48]. O éxon único inteiro do MC4-R foi avaliado com o uso de cinco pares de primers. O seqüenciamento direto identificou um probando [caso índice] no qual uma mutação de deslocamento de quadro de leitura heterozigótica resultou em um receptor truncado não-funcional. A família do probando foi submetida à triagem e foram identificados outros parentes com a mutação. Todos esses parentes tinham níveis semelhantes de adiposidade. A idade dos indivíduos é indicada ao lado do símbolo e o IMC está abaixo do símbolo.
 FIGURA 15-26 FIGURA 15-26
Mutações de POMC. As mutações no gene POMC levam a uma síndrome de insuficiência adrenal, pigmentação vermelha de pêlos e obesidade. A preproopiomelanocortina (POMC) é o precursor de muitos peptídios, inclusive o hormônio adrenocorticotrófico (ACTH), hormônio estimulante de melanócitos (MSH) e b-endorfina. No paciente 1, duas mutações distintas do POMC levaram à interferência na síntese adequada de ACTH e MSH. A insuficiência adrenal resulta da ausência de ACTH. O pêlo vermelho resulta da ausência da regulação pelo MSH da pigmentação no folículo piloso, que seria mediada pelo receptor da melanocortina-1. A obesidade resulta da ausência do MSH agindo centralmente, que regularia a alimentação através do receptor da melanocortina-4 [41]. Uma síndrome de obesidade, insuficiência adrenal e pigmentação vermelha de pêlos foi encontrada em outro paciente descrito por Krude et al. [49]. Este paciente era homozigótico para uma mutação que aboliu a tradução de POMC.
 FIGURA 15-27 FIGURA 15-27
Resumo das mutações nas vias do sistema nervoso central que podem estar associadas à obesidade em seres humanos. Setas azuis apontam para mutações que foram identificadas. Setas cinzas com pontos de interrogação apontam para os sítios em que podem ocorrer mutações, mas que ainda não foram confirmados. AgRP — peptídio liberador de agouti; BHE — barreira hematoencefálica; MC4-R — receptor da melacortina-4; MCH — hormônio concentrador da melanina; MSH — hormônio estimulante de melanócitos; PC1 — pró-hormônio convertase-1; POMC — preproopiomelanocortina; SSC — supressores da sinalização de citocina.
 FIGURA 15-28 FIGURA 15-28
Gene da pró-hormônio convertase 1 e obesidade. Foi descrito pelo menos um paciente gravemente obeso com uma mutação na pró-hormônio convertase-1 (PC1). O paciente era um heterozigoto misto para o gene PC1 [50]. A síndrome clínica deste paciente era muito semelhante àquele encontrada no rato fa/fa. POMC — preproopiomelanocortina.
 FIGURA 15-29 FIGURA 15-29
PPAR-gama2. O receptor ativado pelo proliferador de peroxissomo (PPAR – peroxisome proliferator-activated receptor)-gama2 é um importante regulador da diferenciação de adipócitos. Em um grande estudo de pacientes alemães, foram identificados quatro pacientes obesos com uma mutação "missense" no PPAR-gama2 [51]. Esta mutação resultou na conversão da prolina na posição 115 para uma glutamina. A superexpressão do gene mutante nos fibroblastos de camundongo revelou que a proteína mutante é defeituosa na fosforilação de uma serina na posição 114. Os fibroblastos que expressam o gene mutante exibiram uma diferenciação acelerada em adipócitos. IMC — índice de massa corpórea.
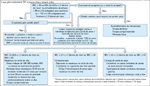 FIGURA 15-30 FIGURA 15-30
Algoritmo baseado em evidências para o tratamento da obesidade. IMC—índice de massa corpórea. (Adaptado de [52].)
voltar
|