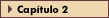  FIGURA 16-1 FIGURA 16-1
Revisão da literatura sobre as relações entre concentraçõesmaternas médias de glicose e mortalidade infantil. Antes do advento dainsulina, um bebê de uma mãe diabética raramente sobrevivia. Antes de 1922,os menos de 100 casos relatados de sobrevivência eram provavelmente filhosde mulheres diabéticas de tipo 2 e não de tipo 1 [13]. Uma revisão dos estudosmais importantes durante os anos desde que a insulina tornou-se comercialmentedisponível e quando foram desenvolvidos os sistemas de controleintensivo da glicose revela que à medida que diminuem as concentraçõesmaternas médias de glicose sangüínea, diminui a mortalidade percentual debebês [30-32]. Uma linha obtida por regressão linear desenhada através dospontos deste gráfico indica que, em um nível médio de glicose materna de 84mg/dL, não haveria aumento de risco de mortalidade infantil em relação aorisco na população geral. O relato de Parretti et al. [34] sobre níveis sangüíneosde glicose em mulheres normais, saudáveis, mostra que o nível médiodiário global de glicose em jejum é de 56 mg/dL e que o pico de resposta pós-prandialocorre 1 hora após a refeição. Este nível de pico nunca excede 105,2mg/dL. A concentração média de glicose calculada na população foi de 85mg/dL, próxima da concentração média projetada de glicose derivada darevisão de literatura [33]. (Adaptado de Jovanovic e Peterson [33]).
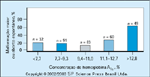 FIGURA 16-2 FIGURA 16-2
Prevalência combinada de malformação maior e aborto espontâneo de acordo com a concentração da hemoglobina glicosilada (HbA1c) durante o primeiro trimestre da gravidez. Na mulher com diabetes preexistente (diabetes pré-gestacional), a gravidez deve ser adiada até que paciente esteja sob um bom controle glicêmico e tenha sido minuciosamente avaliada quanto às complicações do diabetes. O aconselhamento pré-gestacional deve começar no início da puberdade, com a necessidade de abstinência ou contracepção efetiva claramente explicada e compreendida [20]. Os valores de HbA1c fornecem a melhor avaliação do grau de controle glicêmico crônico, refletindo a concentração média de glicose sangüínea durante as 6 a 8 semanas precedentes. Como conseqüencia a medição de HbA1c pode, no início da gravidez, estimar o nível glicêmico durante o período da organogênese fetal [19,28,30-32]. Neste aspecto, há duas conseqüências importantes: 1) Os valores de HbA1c no início da gravidez estão correlacionados com as taxas de aborto espontâneo e malformações congênitas maiores, e 2) a normalização das concentrações de glicose sangüínea antes e no início da gravidez pode reduzir os riscos de aborto espontâneo e malformações congênitas praticamente para aqueles da população geral [5,28,32]. Um relato comparou 110 mulheres que já estavam grávidas há 6 a 30 semanas no momento do encaminhamento, com 84 mulheres recrutadas antes da concepção e, então, colocadas sob um regime de monitorização diária de glicose [28]. A concentração média de glicose sangüínea estava entre 60 e 140 mg/dL (3,3 e 7,8 mmol/L) em 50% destas últimas mulheres. A incidência de anomalias foi de 1,2% nas mulheres recrutadas antes da concepção versus 10,9% naquelas examinas pela primeira vez durante a gravidez. Achados bem semelhantes foram observados em outro estudo: incidência de anormalidades congênitas de 1,4% versus 10,4% [32]. As malformações congênitas maiores (especialmente regressão caudal 252 vezes mais comum no bebê de mãe diabética; situs inversus, 84 vezes mais comum que na população normal; e defeitos renais e cardíacos, 6 e 4 vezes mais comuns no bebê da mãe diabética em comparação com a população normal, respectivamente), que exigem correção cirúrgica ou afetam significativamente a saúde da criança, são mais comuns em bebês de mães com diabetes mal controlado [27]. Há também um aumento substancial em abortos espontâneos em mulheres que entram na gravidez com mau controle metabólico, conforme refletido por um nível elevado de HbA1c [3]. A teratogenicidade da glicose parece ser o principal fator antes da sétima semana de gestação [27]. Esta figura mostra a prevalência combinada de malformação maior e aborto espontâneo de acordo com a concentração de HbA1c durante o primeiro trimestre da gravidez em 315 mulheres com diabetes tipo 1. O risco aumenta acentuadamente nas concentrações de HbA1c de cerca de 11%; outros estudos encontraram um aumento em níveis acima de 9,5% [4,5,28,30-32].
 FIGURA 16-3 FIGURA 16-3
(Veja a Lâmina Colorida) Fetopatia diabética. A complicaçãoneonatal mais comum e significativa claramente associada ao diabetes nagravidez é a macrossomia: um bebê grande demais com um peso ao nasceracima do 90o percentil para idade gestacional e sexo, ou um peso mais de 2 DPacima do peso médio normal ao nascer. Este bebê era macrossômico, pesava4.583 g, nasceu um mês antes do tempo e apresentou todos os sinais de umbebê de uma mãe diabética (hipoglicemia, hipocalcemia, hiperbilirrubinemia) emorreu de desconforto respiratório 2 dias depois de ser tirada esta fotografia.
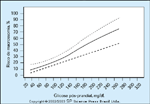 FIGURA 16-4 FIGURA 16-4
Relação entre o pico de concentração pós-prandial de glicosee o risco de macrossomia. Embora controversa, a taxa de complicações emgestações complicadas por diabetes foi vinculada ao controle metabólico daglicose materna [5,18,19,24-26,28,30-32].Talvez o debate ainda continue porquemuitos dos relatos afirmam que ocorrem complicações neonatais apesarde um excelente controle metabólico, mas tais relatos deixam de medir osníveis pós-prandiais de glicose [24-26]. O controle da glicose pós-prandial foisugerido como um ponto crucial para o desfecho neonatal da gestante comdiabetes tipo 1 ou gestacional [23,24]. O estudo Diabetes in Early Pregnancy(DIEP) foi um estudo clínico multicêntrico de gestantes diabéticas tipo 1 queforam comparadas com mulheres controle durante toda a gravidez. Este grupoestudou as relações entre níveis maternos de glicose e risco de macrossomia[24]. O estudo DIEP relatou que os níveis de glicose 1 hora pós-prandialpreviram 28,5% dos bebês macrossômicos nascidos de mães diabéticas. Estafigura mostra que o risco de macrossomia é um continuum. Qualquer picopós-prandial aumenta o risco de macrossomia acima daquele encontrado napopulação normal (risco de 10%). Além disto, quando o pico da resposta pósprandialé maior que 120 mg/dL, então o risco de macrossomia sobe rapidamente.(Adaptado de Jovanovic et al. [24].)
 FIGURA 16-5 FIGURA 16-5
Regressão logística gradativa dos fatores metabólicos maternos e estimativas de composição corpórea neonatal. Catalano et al. [10] avaliaram as relações entre os vários aspectos do metabolismo materno de carboidratos e estimativas de composição corpóreo neonatal. Eles avaliaram 16 bebês de mulheres que participaram de um estudo de longo prazo das alterações no metabolismo da glicose. Os resultados de uma regressão logística em etapas graduais dos fatores do metabolismo materno de carboidratos mostraram que o ganho de peso materno desempenhava o papel mais significativo. (Adaptado de Catalano et al. [10].)
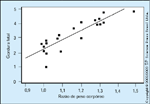 FIGURA 16-6 FIGURA 16-6
Relações entre gordura fetal e subseqüente peso ao nascer.Usando imagem por ressonância magnética (MRI), Jovanovic et al. [35] tambémconstataram que a adiposidade da mãe era um preditor de peso ao nascer. Asrelações entre gordura fetal, determinada pela média de dois pontos de espessuramáxima da gordura subcutânea de parede abdominal fetal em MRI obtidaàs 36 semanas de gestação, em comparação com a razão do peso do bebê aonascer foi altamente significativa (P < 0,001; r = 0,88). (Adaptado de Jovanovic etal. [35].)
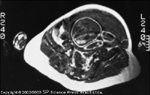 FIGURA 16-7 FIGURA 16-7
Imagem por ressonância magnética do feto de uma mulherdiabética em controle excelente de glicose. Esta imagem foi obtida no nível doumbigo materno às 38 semanas de gestação [35]. A mãe tinha diabetes mellitusgestacional e manteve um excelente controle de glicose, com concentraçõespré-prandiais de glicose de 70 a 90 mg/dL; todos os seus níveis sangüíneos deglicose 1 hora após a refeição foram menores que 120 mg/dL. Este bebê pesou3.900 g ao nascer e era normal quanto à gordura corpórea percentual. (DeJovanovic et al. [35]; com permissão).
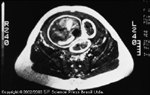 FIGURA 16-8 FIGURA 16-8
Imagem de ressonância magnética do feto de uma mulherdiabética em mau controle de glicose. Esta imagem foi obtida no nível doumbigo materno às 38 semanas de idade gestacional. Como se vê, este fetonão apenas tem gordura subcutânea aumentada, mas já tem também acúmulode gordura visceral [35]. Esta mãe não teve assistência antenatal e se apresentouao pronto-socorro com uma infecção de trato urinário. Foi constatado queela tinha uma grave hiperglicemia. Sua concentração de glicose no momento dainternação era de 396 mg/dL, provavelmente indicando que tinha diabetes tipo2 não diagnosticada. Este feto pesou 4.340 g ao nascer, tinha 50% de seu pesoneonatal composto de gordura e apresentou todos os sinais de um bebê demãe diabética. (De Jovanovic et al. [35]; com permissão.)
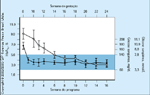 FIGURA 16-9 FIGURA 16-9
Curso temporal para a normalizaçãodo nível materno de hemoglobina glicosiladaem relação à normalização das concentraçõesmaternas de glicose. Um dos primeiros relatos demelhora significativa no desfecho de gestaçõesdiabéticas tipo 1 foi publicado por Jovanovic et al.em 1980 [19]. Demonstramos que, quando osníveis sangüíneos maternos de glicose eram normalizadospor volta da oitava semana gestacional,os pesos ao nascer dos bebês também eramnormalizados. Esta figura mostra o curso temporalpara a normalização da hemoglobina glicosilada(HbA1c) e glicose sangüínea de 10 gestantes comdiabetes tipo 1. Os círculos abertos representam aHbA1c média ± DP. Os círculos fechados representamconcentrações médias de glicose sangüínea ±DP (cada ponto temporal se baseia em 8 a 10determinações de glicose obtidas de todas as 10pacientes ao longo de intervalos de 2 semanas). Aárea sombreada é a faixa normal tanto das concentraçõesde HbA1c como de glicose sangüínea noterceiro trimestre. Todas as 10 mulheres tiverembebês normais no termo. (Adaptado de Jovanovic etal. [19].)
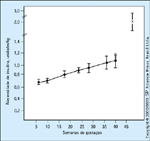 FIGURA 16-10 FIGURA 16-10
A necessidade de insulina durante toda a gravidez emmulheres diabéticas tipo 1. Em um estudo maior de mulheres diabéticas tipo 1que foram mantidas com normoglicemia da sexta semana gestacional emdiante, mostramos que há um aumento regular na necessidade de insulinadurante toda a gravidez. Cinqüenta e três bebês nascidos de 52 mulheresdiabéticas tipo 1 foram todos normais ao nascer. A necessidade de insulina damulher que deu à luz gêmeos foi o dobro daquela das outras 51 mulheres. Estamaior necessidade de insulina se manifestou da sexta semana gestacional emdiante. O "x" mostra a dosagem diária média ± DP de insulina durante as semanas 34 a 37 de gestação. (Adaptado de Jovanovic et al. [18].)
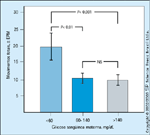 FIGURA 16-11 FIGURA 16-11
Relação entre movimentos fetais e concentrações de glicosematerna. Nesta mesma população de mulheres diabéticas cujo controle deglicose foi documentado no estudo mostrado na Figura 16-10, a avaliação dobem-estar fetal usando o parâmetro de movimentos fetais associados à aceleraçãoda freqüência cardíaca é mostrada aqui. As barras mostram a comparaçãoentre movimentos fetais com acelerações e concentrações maternas de glicosesangüínea menores que 60 mg/dL, concentrações maternas de glicose sangüíneade 60 a 140 mg/dL e concentrações maternas de glicose sangüínea maiores que140 mg/dL. Pode-se ver que os fetos tiveram significativamente mais movimentoscom aceleração da freqüência cardíaca quando as concentrações sangüíneasde glicose eram baixas. Parece, portanto, que uma hipoglicemia leve, transitória,é bem tolerada pelo feto e pode, de fato, ser preferida pelo feto. (Adaptado deHolden et al. [36].)
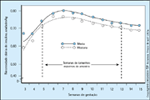 FIGURA 16-12 FIGURA 16-12
Necessidade decrescente deinsulina no primeiro trimestre de gestantesdiabéticas tipo 1. No estudo Diabetes in EarlyPregnancy Study, foi estudada a necessidade deinsulina no primeiro trimestre. A dosagem diária deinsulina (expressa como uma média ou medianasemanal em unidades por kg das semanas 3 a 8)aumentou, mas houve um decréscimo na dosagemde insulina no final do primeiro trimestre. Oscírculos abertos representam a dosagem média de346 mulheres diabéticas tipo 1 que tiveram bebêssaudáveis. Os círculos fechados representam adosagem mediana destas mesmas pacientes.(Adaptado de Jovanovic et al. [37].)
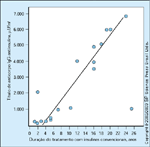 FIGURA 16-13 FIGURA 16-13
Relação entre níveis de anticorpos antiinsulina e duraçãodo tratamento com insulina animal. Embora a glicose materna seja o agentecausal mais provável da macrossomia neonatal, alguns sugeriram que amorbidade neonatal seria secundária à variabilidade da glicose sérica materna eà presença de anticorpos contra a insulina. A transferência placentária deinsulina ligada à imunoglobulina G (IgG) também foi associada à macrossomiafetal em mães com um controle glicêmico quase normal durante a gestação.Menon et al. [38] relataram que insulina ligada a anticorpo transferida ao fetofoi proporcional à concentração de insulina ligada a anticorpo mensurada namãe. Além disto, a quantidade de insulina ligada a anticorpo transferida ao fetoapresentou uma correlação direta com macrossomia no bebê e foi independentedos níveis sangüíneos maternos de glicose. Em contraste, os pesquisadoresdescobriram que somente um melhor controle de glicose, conformeevidenciado por excursões menores de glicose pós-prandial, mas não níveismenores de anticorpo antiinsulina, apresentava correlação com menor pesofetal [39]. Eles demonstraram que anticorpos antiinsulina contra insulinaexógena não influenciam o peso do bebê ao nascer nem a dosagem de insulina.No entanto, eles de fato relataram que há uma relação entre a duração dotratamento com insulina convencional e o título de anticorpo IgG, comomostrado aqui. (Adaptado de Jovanovic et al. [40].)
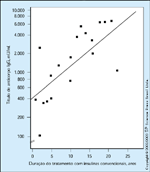 FIGURA 16-14 FIGURA 16-14
Relação entre níveis de anticorpo e anos de tratamento com insulina animal. Quanto mais longo o tratamento com insulina animal, maiores os níveis de anticorpo de imunoglobulina G (IgG).
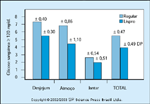 FIGURA 16-15 FIGURA 16-15
Concentrações pós-prandiais de glicose de mulheres diabéticas tratadas com insulina lispro comparadas a concentrações pós-prandiais de glicose de mulheres diabéticas tratadas com insulina humana durante a gravidez. Nosso grupo relatou que a insulina lispro, um análogo da insulina humana com um pico de ação da insulina atingido 1 hora após a injeção, melhora significativamente as concentrações pós-prandiais de glicose em pacientes diabéticas grávidas. Mostramosque o nível de glicose pós-prandial é significativamente menor durante toda agravidez em mulheres diabéticas gestacionais que precisam de insulina tratadas com insulina lispro em comparação com mulheres diabéticas gestacionais tratadas com insulinahumana. (Adaptado de Jovanovic et al. [41].)
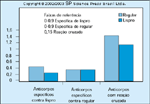 FIGURA 16-16 FIGURA 16-16
Achados de anticorpo antiinsulina. Os níveis de anticorposnão foram diferentes nas mulheres tratadas com insulina lispro, em comparaçãocom insulina humana. Além disto, não se conseguiu detectar lispro no sangue decordão dos bebês cujas mães foram tratadas com lispro. Por causa da importânciade se abrandar o pico de concentração pós-prandial de glicose e da falta deimunogenicidade dos análogos de insulina de ação rápida, o tratamento a serindicado na gravidez é o de sugerir agora que estas insulinas sejam usadas emgestações complicadas pelo diabetes. Entretanto, ainda não foram publicadosdados de estudos clínicos de grande porte em mulheres diabéticas tipo 1.(Adaptado de Jovanovic et al. [41].)
 FIGURA 16-17 FIGURA 16-17
Esquema de dosagem de insulina durante a gravidez diabética.Foi demonstrado que este algoritmo de tratamento atinge glicemia normalem mulheres diabéticas pré-gestacionais. As doses de insulina são divididas eminjeções freqüentes para suprir as necessidades de insulina, basais e relacionadasà refeição. O aumento regular na necessidade diária total de insulina durantetoda a gravidez é calculado com base na semana gestacional e peso gestacionalmaterno. A necessidade de insulina nas semanas 0 a 12 de gestação é de0,7 U/kg/d (com monitorização cuidadosa dos níveis sangüíneos de glicose paraimpedir a ocorrência de hipoglicemia se houver um declínio na dosagem duranteas semanas 9 a 12). Durante as semanas 13 a 28 de gestação, a dosagem é de0,8 U/kg/d; durante as semanas 29 a 34, a necessidade de insulina é de 0,9U/kg/d. No termo, a necessidade de insulina é de 1,0 U/kg/d [18]. BS — bloodsugar [açúcar no sangue]. (Adaptado de Jovanovic e Peterson [22].)
 FIGURA 16-18 FIGURA 16-18
Protocolo de testes recomendadopara mulheres com diabetes pré-gestacional.Idealmente, uma mulher diabética planeja suagravidez para que haja tempo para a criação de umalgoritmo individualizado de assistência. Quandouma mulher diabética se apresenta nas suas primeiraspoucas semanas de gravidez, não há tempo paraa individualização e protocolos um tanto rígidosdeverão ser instituídos com urgência para proporcionarum controle ótimo em questão de 24 a 48horas e manter o controle a partir de então[20,28]. A tabela lista os testes importantes para amonitorização de doenças concomitantes e oestado vascular materno durante a gravidez [23].HbA1c — hemoglobina A1c; T4 — tiroxina.
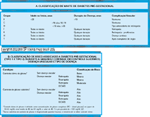 FIGURA 16-19 FIGURA 16-19
Duas classificações de diabetespré-gestacional. Classificações de diabetespré-gestacional foram formuladas para ajudar omédico a predizer o desfecho da gravidez paramãe e filho [43,44]. A, A classificação de White[43] categorizou mulheres diabéticas com baseno modo de terapia, duração, idade de início dodiabetes e o grau de comprometimento vascularde cada paciente no início da gravidez. A classeA de White era referente ao diabetes gestacional,mas muitas dessas mulheres provavelmentetinham diabetes tipo 2 não-diagnosticado. A classificaçãode White também provocou confusão,porque a determinação "B" era dada tanto aodiabetes relacionado à gravidez (diabetes gestacional)que exigia insulina quanto à mulher pré-gestacionalcom menos de 10 anos de terapiacom insulina. O tratamento para todos os gruposconsistia em dieta e insulina. B, Classificaçãorevisada. À medida que se acumulam as evidênciasde que a normoglicemia materna é benéficano momento da concepção, durante a organogênesefetal e durante toda a gestação, umaclassificação mais nova que dê mais ênfase paraas concentrações plasmáticas maternas deglicose torna-se uma alternativa aceitável àversão de White. Esta classificação se baseia noestado vascular e tipo de complicação, comênfase sobre o controle glicêmico [23]. DCVAS— doença cardiovascular aterosclerótica.
voltar |