  FIGURA 16-20 FIGURA 16-20
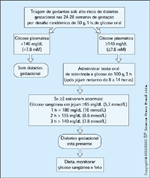
Protocolo terapêutico para triagem e diagnóstico de diabetesgestacional. Diabetes mellitus gestacional (DMG) é definido como tolerância àglicose de gravidade variável com início ou primeiro reconhecimento durante agravidez. A prevalência de diabetes gestacional é dependente de antecedenteétnico e grau de adiposidade e, assim, varia de 0,1% a 12% [16]. Hoje, a maioriados centros médicos usa um procedimento diagnóstico em dois estágios sugeridona Third International Workshop-Conference on Gestational Diabetes realizadaem Chicago em 1991, a saber, triagem com desafio de glicose, com confirmação,se necessário, por teste oral de tolerância à glicose. O artigo sobre a posiçãoatual, apresentado em 1997 na Fourth International Workshop-Conference onGestational Diabetes Mellitus em Chicago, sintetiza as mais recentes recomendações[29]. O teste de desafio da glicose (TTG) é realizado nas semanas 24 a 28 degestação para pacientes de risco moderado e no início da gravidez para pacientesde alto risco, independentemente da hora da última refeição. O teste envolve aingestão oral de 50 g de glicose em 2 minutos e medição do nível plasmático deglicose após 1 hora. As pacientes com um nível de glicose maior que 140 mg/dLno TTG (14% a 18% de todas as gestantes) devem então ser submetidas ao testeoral de tolerância à glicose (TOTG) para confirmação de DMG. Este subgruporesponde por cerca de 80% de todas as mulheres com DMG. Alguns centrosmédicos usam um valor de corte de 130 mg/dL no TTG, que identifica mais de90% de todas as pacientes afetadas, mas esse valor aumenta o subgrupo que precisade TOTG para 20% a 25% de todas as gestantes. O TOTG identifica pacientescom diabetes pela carga de glicose. Antes do teste, as pacientes ingerem por 3dias uma dieta de mais de 150 g de carboidratos com atividade física regular,seguido de um jejum de pelo menos 8 horas (mas não mais de 14 horas). O testeé realizado na manhã do quarto dia. Para diagnóstico, os valores de dois dosquatro critérios listados nesta figura devem ultrapassar o valor de corte predeterminado,como indicado. De acordo com as recomendações mais recentes [29], osclínicos podem usar uma carga de 75 g ou 100 g de glicose e valores de corteiguais para ambos os testes. É importante enfatizar que os valores de glicose deteste em sangue capilar por picada de dedo não são aceitos para diagnóstico. Odiagnóstico de DMG deve se basear unicamente nos níveis plasmáticos de glicoseem um TOTG.
 FIGURA 16-21 FIGURA 16-21
Guia de avaliação de risco para mulheres que precisam sersubmetidas à triagem de diabetes gestacional. O risco de diabetes mellitus gestacional(DMG) é estratificado em baixo, médio e alto [29]. A avaliação de riscodeve ser realizada na primeira consulta pré-natal. Mulheres com característicasclínicas compatíveis com alto risco (obesidade, história pessoal de DMG, glicosúriaou forte história familiar de diabetes) devem ser testadas o mais rapidamentepossível. Mulheres de médio risco devem ser testadas nas semanas 24 a28 de gestação e mulheres de baixo risco não precisam ser testadas. Entretanto,existem muitos que são favoráveis a uma triagem universal para todas asgestantes pois não existe nenhum meio de garantir que uma mulher sem"nenhum risco" não terá DMG [44]. Um nível de glicose acima de 126 mg/dLapós 8 a 14 horas de jejum e/ou nível plasmático casual de glicose acima de200 mg/dL são diagnósticos de diabetes; portanto, não é necessário nenhumteste adicional. A avaliação deve ser feita o mais cedo possível durante agravidez. Novas diretrizes podem ser esperadas ao término do estudo multinacionalHyperglycemia and Adverse Pregnancy Outcome (HAPO), de 4 anos,que está sendo conduzido sob a égide dos Institutos Nacionais de Saúde (NIH)dos EUA em 16 importantes centros médicos, inclusive dois em Israel. Oestudo busca definir critérios para a carga de 75 g de glicose, que já é aceitaem vários países europeus, para padronizar o diagnóstico de DMG com o diagnósticode diabetes no estado não-gestacional. TTG — teste de tolerância àglicose; TOTG — teste oral de tolerância à glicose.
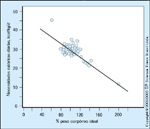 FIGURA 16-22 FIGURA 16-22
As necessidades calóricas de uma gestante com base em seu peso corpóreo ideal. A principal meta terapêutica do diabetes mellitus gestacional (DMG) é evitar efeitos adversos à mãe e ao bebê. A normalização dosníveis de glicose é comprovadamente um fator para atingir esta meta. Alémdisto, níveis pós-prandiais de glicose estão mais intimamente associados àmacrossomia que os níveis de jejum. Mulheres com DMG devem seguir umadieta individualmente ajustada, preparada por nutricionista, que também leveem consideração a quantidade, o tempo e o tipo de injeção de insulina (senecessário). A dieta deve satisfazer as necessidades nutricionais diárias mínimasde todas as gestantes. A ingestão calórica deve ser compatível com o estado degravidez e garantir um ganho de peso adequado de acordo com o peso idealda paciente antes e durante a gravidez. Nesta figura, as necessidades calóricasda gravidez são relacionadas ao peso corpóreo materno. Os círculos fechadosmostram que, para uma mulher de peso corpóreo normal (entre 80% e 120%do peso corpóreo ideal), a necessidade calórica é de 30 quilocalorias por quilograma(peso atual da gestante) por dia. Para mulheres com sobrepeso, sãonecessárias menos calorias. A maioria das mulheres com sobrepeso está 130%acima do peso corpóreo ideal e precisa de 24 quilocalorias por quilograma.Mulheres morbidamente obesas (mais de 150% acima do peso corpóreo ideal)poderão precisar de apenas 12 quilocalorias por quilograma (peso atual dagestante) [46]. (Adaptado de Jovanovic [45].)
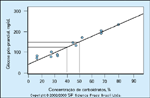 FIGURA 16-23 FIGURA 16-23
Relações entre concentração de carboidratos, o plano de refeiçõese o pico da resposta pós-prandial. As calorias são divididas em refeições pequenas e freqüentes com a advertência de que o desjejum precisa ser a menor refeição do dia, com menos de 33% de carboidratos. Este grau de restrição de carboidratos é necessário pois a hipercortisolemia normalmente observada nas primeiras horas depois do despertar é potencializada na gravidez.Depois que os níveis de cortisol declinam, as outras refeições podem então ser compostas de 40% de carboidratos. Esta figura mostra claramente que,quando a concentração de carboidratos no almoço e jantar é maior que 40%, o pico do nível pós-prandial de glicose é maior que 120 mg/dL, ou aquele nível que, segundo os relatos, está associado a um risco rapidamente crescente demacrossomia neonatal [24]. (Adaptado de Peterson e Jovanovic [47].)
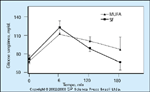 FIGURA 16-24 FIGURA 16-24
Concentrações pós-prandiais de glicose depois de uma refeiçãocom gordura saturada (SF – saturated fat) comparadas àquelas concentraçõesapós uma refeição com gordura monoinsaturada (MUFA – monounsaturatedfat). Esta figura demonstra que a adição de SF ou de MUFA ao plano darefeição tem diferentes efeitos sobre as concentrações pós-prandiais de glicose.Apesar do pico quase normal da resposta pós-prandial no ponto temporalde 1 hora com SF em comparação com MUFA, nos pontos temporais de 2 e 3horas, os níveis sangüíneos de glicose são significativamente menores com umarefeição com SF. Se a macrossomia é causada pela carga total de glicose pósprandial,então planos de refeição com SF podem realmente constituir ummeio de minimizar a necessidade de terapia com insulina em pacientes comdiabetes mellitus gestacional. (Adaptado de Ilic et al. [48].)
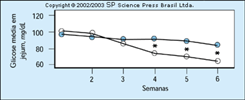 FIGURA 16-25 FIGURA 16-25
Concentrações de glicose em jejum semanais durante umprograma de treinamento cardiovascular em comparação com ausência deprograma de exercícios em mulheres com diabetes gestacional. Um exercíciode braço se revelou um modo seguro e efetivo de terapia para o tratamentodestas mulheres. Um dos grupos documentou que mulheres com diabetesgestacional podem treinar usando uma ergometria de braço e que um programacom este tipo de exercícios de condicionamento cardiovascular resulta emníveis mais baixos de glicemia que um programa apenas de dieta. Os efeitos deexercícios sobre as concentrações de glicose em jejum tornaram-se evidentesapós 4 semanas de treinamento, como mostram os círculos sólidos. (Adaptado deJovanovic et al. [49].)
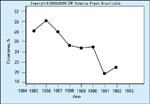 FIGURA 16-26 FIGURA 16-26
A queda no índice de cesarianas no Condado de SantaBárbara concomitantemente com a introdução de um programa de triagemuniversal e tratamento de hiperglicemia na gravidez. Quando não se conseguemanter o nível de glicose dentro dos limites recomendados (90 mg/dL antes dasrefeições e não maior que 120 mg/dL 1 hora após as refeições) por dieta eexercícios, então o tratamento com insulina é necessário. Análogos de insulinade ação rápida podem melhorar os níveis glicêmicos e seu uso é crescente namaioria dos centros mais importantes dos Estados Unidos e Europa. Nossaexperiência no Serviço de Assistência Médica do Condado de Santa Barbara[44] com um programa de triagem universal e tratamento da glicose pós-prandialcuja meta é um nível de glicose sangüínea menor que 120 mg/dL (com dieta,exercícios e início de insulina quando os níveis sangüíneos de glicose estãoelevados) mostrou que o peso ao nascer é normalizado. Este grau de cuidadosintensivos para todas as mulheres diabéticas gestacionais resulta numa economiade mais de US$ 2.000 por gravidez por evitar as cesarianas necessárias para oparto de bebês macrossômicos e internações dos bebês enfermos em unidadeintensiva neonatal. (Adaptado de Jovanovic e Bevier [44].)
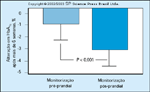 FIGURA 16-27 FIGURA 16-27
Níveis de hemoglobina glicosilada após 6 semanas de monitorizaçãoapenas das concentrações pré-prandiais de glicose em mulheresdiabéticas gestacionais necessitando de terapia insulínica, em comparação comos níveis de hemoglobina glicosilada obtidas em uma população equivalente demulheres que estavam também monitorando as concentrações pós-prandiaisde glicose. De Veciana et al. [26] também mostraram que quando as mulheresdiabéticas gestacionais que precisam de insulina medem apenas seus níveispré-prandiais de glicose, a prevalência de macrossomia é de 42%. Quando osníveis pré-prandiais de glicose são medidos e o tratamento é planejado paramanter os níveis menores que 120 mg/dL, a prevalência de macrossomia foireduzida para 12%. Com apenas 6 semanas de tratamento planejado paraabrandar os níveis pós-prandiais de glicose, a hemoglobina glicosilada foi significativamentemenor que no grupo de pacientes com diabetes gestacional queestavam monitorando apenas a glicose pós-prandial.
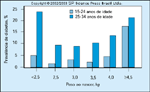 FIGURA 16-28 FIGURA 16-28
Relação entre peso ao nascer e o risco de diabetes subseqüente.Mulheres que tiveram diabetes mellitus gestacional anteriormentedevem ser aconselhadas a repetirem o teste oral de tolerância à glicose umavez por ano e a manterem um estilo de vida saudável, com exercícios regularese peso corpóreo normal para a sua constituição física. Elas devem buscar umaconsulta antes de sua próxima gravidez [29]. O acompanhamento dos filhos demães diabéticas deve incluir medições cuidadosas do crescimento e desenvolvimentoe vigilância para a intolerância à glicose durante a infância. Os filhos demães diabéticas encontram-se sob maior risco de obesidade e intolerância àglicose. Acumulam-se as evidências de que um bom controle metabólico da mãedurante a gravidez pode reduzir esse risco. Parece haver uma curva em formade U que relaciona o peso ao nascer ao risco de diabetes subseqüente.Tantono baixo quanto no alto peso ao nascer, parece que os bebês têm uma falta dereserva pancreática de insulina e, portanto, à medida que crescem e se desenvolvem,não conseguem aumentar suficientemente a sua secreção de insulinapara manter a homeostase de glicose. (Adaptado de McCance et al. [50].)
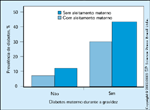 FIGURA 16-29 FIGURA 16-29
Preditores de diabetes subseqüente nos descendentes deíndios Pima. Pettitt e Knowler [12] relataram que existe uma conseqüência delongo prazo do ambiente intra-uterino. Quando eles fizeram o ajuste paraidade, sexo, peso ao nascer, presença de diabetes em qualquer um dos pais e sea criança foi ou não amamentada durante pelo menos 2 meses após o nascimento,os preditores mais fortes de diabetes subseqüente na criança foram apresença de diabetes materno e o fato de não ter sido amamentada com leitematerno. As barras escuras representam as crianças que não foram amamentadas;as barras claras representam as crianças que foram amamentadas. Portanto,é evidente que o ambiente intra-uterino deve ser normalizado e que deve serfornecida uma nutrição suficiente (mas não nutrição excessiva). A manutençãodo estado nutricional da criança após o nascimento é extremamente importantepara diminuir o índice rapidamente crescente de diabetes no futuro.(Adaptado de Pettitt e Knowler [12].)
voltar |