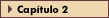 FIGURA 2-10 FIGURA 2-10
Transportadores de glicose. O transporte de glicose é mediado por uma família de carregadores facilitadores de glicose, ou transportadores de glicose. Estas proteínas têm uma estrutura típica, que inclui um aminoterminal citoplasmático seguido de 12 domínios que se estendem pela membrana e uma cauda citoplasmática. É mostrada a estrutura proposta do transportador-4 de glicose responsivo à glicose (GLUT4). A primeira alça exofacial contém sítios de glicosilação, ao passo que o domínio citoplasmático carboxiterminal contém um sítio putativo de fosforilação (serina 488) e um motif dileucina que se acredita que desempenha um papel na rápida endocitose do GLUT4. É também mostrado o sítio proposto de ligação ao substrato [48]. Existem evidências de oito membros diferentes da família de genes de transportadores de glicose. GLUT1 é expresso em todos os tecidos e linhagens celulares e responde pela maior parte da captação basal (insulino independente) de glicose. GLUT2 é expresso principalmente no fígado e células b pancreáticas; por causa de sua afinidade relativamente baixa e sua alta capacidade pela glicose, ele serve para proporcionar um fluxo constante de glicose para dentro desses órgãos em concentrações plasmáticas fisiológicas de glicose (5 mM). Na célula b, a captação de glicose através de GLUT2 é a primeira etapa na detecção de níveis circulantes de glicose. GLUT3 é expresso ubiquamente e possui uma afinidade relativamente elevada pela glicose. Curiosamente, GLUT3 é abundante no sistema nervoso central, onde as concentrações de glicose são menores que na corrente sangüínea. A presença de um transportador de glicose de alta afinidade oferece um mecanismo para uma captação eficiente de glicose pelos neurônios. GLUT4 é o transportador de glicose responsivo à insulina prototípico. GLUT4 é encontrado em vesículas intracelulares em tecidos responsivos à insulina, que incluem músculo esquelético, células adiposas e coração. Existem atualmente evidências da presença de mais um transportador de glicose responsivo à insulina, GLUT8. GLUT5 é um transportador de frutose expresso na membrana epitelial intestinal e rim. GLUT6 é um pseudogene não-funcional. GLUT7 é um transportador microssômico de glicose que faz parte do complexo glicose-6- fosfatase que se acredita que desempenhe um papel na liberação de glicose do retículo endoplasmático [48].
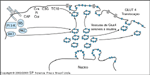 FIGURA 2-11 FIGURA 2-11
Ação da insulina no transporte de glicose. Nos tecidos que são responsivos à insulina para captação de glicose, GLUT4 está presente em condições basais nas vesículas intracelulares. Vesículas contendo GLUT4 são liberadas de compartimento de depósito intracelular e atingem a superfície celular durante a estimulação insulínica. O mecanismo de redistribuição de transportadores de glicose induzida pela insulina é conhecido como translocação. Não se sabe se o efeito da insulina de estimular a captação de glicose no músculo e na gordura pode ser explicado integralmente pela hipótese da translocação. Outros fatores, como um aumento na atividade de transportadores de glicose, poderiam desempenhar um papel. Existem evidências substanciais que sugerem que a atividade da fosfatidilinositol 3-quinase (PI 3-K) medeia o efeito da insulina sobre o transporte de glicose. Além da atividade da PI 3-K, outros sinais parecem ser necessários para a captação de glicose estimulada pela insulina, inclusive uma segunda via envolvendo a fosforilação em tirosina do proto-oncogene de Cbl [49]. Na maioria das células responsivas à insulina, a Cbl está associada à proteína adaptadora CAP, que se liga a seqüências ricas em prolina na Cbl através de seu domínio SH3 caboxiterminal. Após fosforilação, o complexo Cbl–CAP se associa à flotilina nos ‘rafts’ (‘jangadas’) lipídicos de membrana plasmática onde a fosfo-Cbl recruta o complexo CrkII-C3G. O CrkII forma um complexo constitutivo com a C3G, uma proteína de troca de guanil nucleotídeo que catalisa a troca de GTP por GDP na proteína-G TC10. A TC10 ativada pode contribuir para a estabilização da actina cortical e fornecer à proteína GLUT4 um segundo sinal que funciona em paralelo com a ativação da via da PI 3-K.
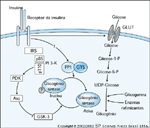 FIGURA 2-12 FIGURA 2-12
Estimulação da síntese de glicogênio pela insulina. A insulina desempenha um papel essencial na estimulação da síntese de glicogênio em muitos tecidos. Este processo envolve a regulação de várias atividades enzimáticas. A atividade da glicogênio sintase (GS) é regulada por fosforilação. Esta enzima crucial é inativa quando fosforilada [50]. A glicogênio sintase quinase-3 (GSK-3) é uma enzima que catalisa a fosforilação e a inativação da glicogênio sintase. A própria GSK-3 é inativada por fosforilação. A insulina estimula a fosforilação da GSK-3 através da ativação da Akt quinase (produto do protoonco-gene de akt). A Akt é ativada em resposta à fosfatidilinositol 3-quinase (PI 3-K) através das quinases-1 e 2 dependentes de PI (PDK1 e PDK2). A Akt pode fosforilar e inativar a GSK-3, reduzindo portanto a taxa líquida de fosforilação da GS [51]. Adicionalmente, foi demonstrado que a insulina aumenta a atividade da forma ligada ao glicogênio da serina/treonina proteína fosfatase-1 (PP1) que desfoforila e ativa a GS [52]. O mecanismo exato da estimulação de PP1 pela insulina não foi ainda elucidado [53]. A síntese de glicogênio exige a montagem de um complexo de proteínas, inclusive a glicogenina, para fornecer um arcabouço molecular, enzimas ramificantes e uma variedade de subunidades com alvo dirigido ao glicogênio (GTS – glycogen targeting subunits) que regulam a localização e atividade da PP1 [54]. Estudos atualmente em andamento investigam até que ponto a insulina regula a localização e/ou função da GTS. Foi também demonstrado que o transporte de glicose estimulado pela insulina contribui para a regulação da GS [55].
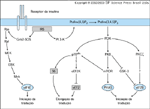 FIGURA 2-13 FIGURA 2-13
Regulação da síntese proteica pela insulina. A insulina estimula tanto a iniciação quanto a elongação, alterando a atividade intrínseca ou as propriedades de ligação de certos fatores-chave. Isto ocorre via fosforilação ou seqüestro de fatores repressivos em um complexo inativo. Os componentes da maquinaria de tradução que são alvos da regulação insulínica incluem eIF2B, eIF4E, eIF4G, S6, eEF1 e eEF2 [56]. O glicogênio sintase quinase-3 (GSK-3) fosforila eIF2B em Ser540, mantendo-a inativa. A insulina estimula a inibição da GSK-3 que, por sua vez, leva à ativação de eIF2B [48,50]. A insulina também estimula a atividade da eIF2B através da ativação dependente de PI 3-quinase da proteína quinase C atípica, PKCz [57]. Esta ativação da eIF2B leva a um aumento global na iniciação da tradução [58]. A proteína de ligação ao cap do mRNA (mRNA cap-Ras binding protein), eIF4E, é inativa quando ligada à PHAS-I. A insulina ativa a eIF4E estimulando a fosfo-Grb2- rilação mediada por mTOR da PHAS-I, resultando numa dissociação deste complexo [59]. A Mnk é ativada pela insulina através da cascata do Ras/ERK [60]. A Mnk aumenta a afinidade da eIF4E pelos caps via fosforilação em Ser209 [61]. A fosforilação e subseqüente afinidade da eIF4G, outro membro do complexo ativo de ligação ao cap (active cap-ERK binding complex) pela eIF4E, é também estimulada pela insulina [62,63]. A formação do complexo ativo de ligação ao cap leva a um aumento da iniciação da tradução. A insulina também estimula a elongação pela fosforilação de eEF1 e S6, a última ocorrendo tanto pela S6 quinase multipotencial quando pela p70s6K. eEF2, um importante fator no processo de elongação, é inativa quando fosforilada [64]. A insulina estimula a desfosforilação da eEF2 via uma rota sensível à rapamicina, envolvendo possivelmente a fosforilação e a inativação da eEF2 quinase pela p70s6K [65]. Outros fatores de crescimento agindo através de tirosina quinases do receptor produzem alterações semelhantes na síntese proteica, eg, fator de crescimento derivado de plaqueta, fator de crescimento neural e fator de crescimento epidérmico.
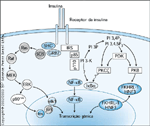 FIGURA 2-14 FIGURA 2-14
Regulação da expressão gênica pela insulina. A insulina efetiva a expressão gênica-alvo em diversas células e órgãos. Foi demonstrado que as vias de sinalização tanto da fosfatidilinositol 3-quinase (PI 3-K) quanto da Ras/quinase de regulação extracecular (ERK – extracellular-regulated kinase) medeiam a ação da insulina sobre a transcrição gênica em diferentes tecidos. A via Ras/ERK ativa a p90rsk, pela qual a ERK e a p90rsk translocam-se individualmente ao núcleo e fosforilam os fatores de transcrição, inclusive elk1 e fos. Estes eventos de fosforilação aumentam a atividade transcricional mediada por tais fatores. A via PI 3-K ativa a proteína quinase B (PKB) através da proteína quinase dependente de PI (PDK). A PKB ativa fosforila membros da família do enhancer transcricional FKHR, que inclui FKHR-L1 e HNF3, os quais, sob condições basais, estão localizados no núcleo. A fosforilação destes fatores FKHR leva à sua exclusão nuclear e retenção citoplasmática, inibindo efetivamente a transcrição gênica específica [66]. A insulina também efetiva a dissociação do complexo inibitório de IkB da NF-kB. NF-kB estará então livre para entrar no núcleo e ativar a transcrição gênica-alvo. Foi demonstrado que a estimulação da NF-kB pela insulina é sensível a inibidores da PI 3-K, implicando o envolvimento da via da PI 3-K [67]. A ativação da proteína quinase C atípica, como a PKCz, também pode contribuir para a ativação da NF-kB. A regulação da NF-kB pela insulina ainda não foi elucidada.
voltar |