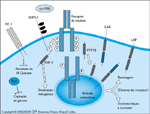
 FIGURA 2-15 FIGURA 2-15
Moduladores da ação da insulina. Vários sinais convergem no receptor da insulina (IR – insulin receptor) para modular sua função. As proteína-tirosina fosfatases (PTP – protein tyrosine phospha- tases) parecem desempenhar um papel importante na desativação do IR, fornecendo um mecanismo para regular a resposta insulínica. A etapa endocítica que se segue à ligação com a insulina, com internalização do completo ligante/receptor para dentro das vesículas recobertas de clatrina, pode ser mais um ponto para a desfoforilação do receptor. O endossomo foi identificado como um importante sítio de atividade da tirosina fosfatase com respeito ao IR [68]. Muitos estudos de seres humanos e roedores obesos resistentes à insulina demonstram alterações na expressão e/ou atividade das PTPs nos tecidos responsivos à insulina [69–73]. Há duas classes principais de tirosina fosfatases: de tipo receptor (ligada à membrana) e de tipo não-receptor (citosólica). As tirosinas fosfatases identificadas como IR fosfatases incluem LAR e LRP (de tipo receptor) bem como PTP1B (citosólicas). Estas fosfatases podem também alterar a sinalização da insulina definindo substratos IR como alvos de desfosforilação. Estudos em camundongos transgênicos revelam que uma superexpressão de LAR em músculo resulta em resistência à insulina no corpo todo [74]. Camundongos com knockout para PTP1B são resistentes à obesidade e exibem maior sensibilidade à insulina [75,76]. Várias outras moléculas afetam a ação da insulina. Foi proposto que a glicoproteína de membrana PC-1 exerceria um efeito negativo sobre a função do IR por deprimir sua atividade de quinase [77]. Os estudos indicam uma correlação entre a expressão de PC-1 e a resistência à insulina em paciente com tiabetes tipo 2 [78]. Outro inibidor da IR quinase é a glico-proteína sérica a2-HSG. Foi relatado que esta proteína de 63 kDa inibe a autofosforilação do receptor induzida pela insulina, bem como a fosforilação do substrato-1 do IR e do substrato do IR Shc, com uma redução associada das ações mitogênicas da insulina. Não houve relato de nenhum efeito da a2-HSG sobre as funções metabólicas da insulina [79]. Originalmente, a proteína semelhante ao ras associada ao diabetes (Rad – ras-like protein associated with diabetes) foi identificada por hidribização subtrativa como um gene superexpresso em pacientes com diabetes. Embora estudos subsqüentes não tenham sido capazes de confirmar esta associação, é interessante que a superexpressão da Rad em células transfectadas comprometa a captação de glicose insulino-dependente [80]. A glicoproteína transmembranar SHPS-1 é fosforilada e forma um complexo com a SHP-2, uma PTP não-receptor, em resposta à insulina. Este complexo parece intensificar a atividada da ERK em resposta à insulina [81].
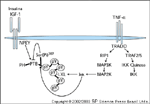 FIGURA 2-16 FIGURA 2-16
Fator-a de necrose tumoral (TNF-a) como modulador da ação da insulina. A importante idéia de que a inflamação está associada à resistência à insulina é conhecida há muito tempo [82] e é compatível com o achado de que citocinas induzidas por estresse, como TNF-a, causam resistência à insulina. As cascatas de sinalização reguladas pelo TNF-a são complexas e envolvem muitos pontos de ramificação, inclusive a ativação de várias serina quinases e fatores de transcrição que promovem a apoptose ou a proliferação [83]. Uma das ramificações da via de sinalização do TNF-a envolve a ativação da c-Jun N-terminal quinase (Jnk) [84–86]. A Jnk é uma quinase induzida por estresse prototípica que é estimulada por muitos agonistas durante uma inflamação aguda ou crônica. A Jnk fosforila inúmeras proteínas celulares, inclusive IRS-1 e IRS-2, Shc e Gab1 [87]. Um papel para a Jnk durante a ação da insulina é forçoso, já que tanto o IRS-1 como o IRS-2 contêm motifs de ligação ao Jnk. Este motif medeia a associação específica da Jnk com o IRS-1, que promove a fosforilação de um resíduo de serina específico que está localizado no lado COOH-terminal do domínio de ligação à fosfotirosina (PTB – phosphotyrosine-binding) (Ser307 no IRS-1 murino; Ser312 no IRS-1 humano). A fosforilação deste resíduo inibe a função do domínio PTB, que perturba a associação entre o receptor da insulina e o IRS-1 e inibe a fosforilação de tirosina [87]. Neste modelo, a ligação do TNF-a com um receptor tipo 1 de TNF (TNFR1) resulta no recrutamento do fator 2/5 associado ao receptor de TNF (TRAF2/5 – TNF–receptor-associated factor 2/5) e proteína-1 de interação com o receptor (RIP1 – receptor-interacting protein 1) através da proteína adaptadora TRADD. O TRAF2/5 e a RIP1 promovem a ativação das proteína quinases Jnk e IkB quinase (IKK). A Jnk ativada se associa ao motif LXL de ligação à Jnk no IRS-1, que promove a fosforilação de Ser307. A fosforilação de Ser307 inibe a função do domínio PTB e inibe a fosforilação de tirosina estimulada pela insulina/IGF e a transdução de sinal.
voltar |