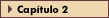 FIGURA 3-8 FIGURA 3-8
Mecanismos de regulação da glicose. O suprimento de glicose ao cérebro poderá ser mantido por dias e mesmo semanas quando o corpo tiver sido privado de ingestão calórica. No estado alimentado (esquerda), a assimilação de combustíveis metabólicos e substratos é promovida pela insulina nos tecidos sensíveis ao hormônio. Na cetoacidose diabética (CAD) (direita), hormônios contra-regulatórios (notavelmente o glucagon e a adrenalina) revertem esses processos, promovendo a glicogenólise e criando substratos para a cetogênese e a neoglicogênese [14–17]. Negar glicose a tecidos sensíveis à insulina preserva-a para o cérebro. (Adaptado de Kitabchi e Rumbak [17].)
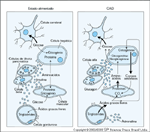
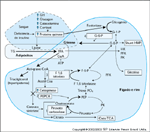 FIGURA 3-9 FIGURA 3-9
Alterações bioquímicas propostas que ocorrem durante a cetoacidose diabética. Estas alterações levam a um aumento de neoglicogênese e lipólise e uma redução de glicólise. Nota: Ocorre lipólise principalmente no tecido adiposo. Ocorrem outros eventos primariamente no fígado (exceto uma certa neoglicogênese no rim) [18]. Setas grossas indicam vias estimuladas na cetoacidose diabética, que consistem nas enzimas limitantes de velocidade da neoglicogênese, enquanto setas finas indicam vias inibitórias na glicólise. O ciclo dos ácidos tricarboxílicos (TCA) é inibido pela inibição da síntese de citrato induzida por acil-graxo e acil coenzima A (CoA), uma enzima limitante de velocidade no ciclo TCA. ATP — trifosfato de adenosina; FFA — free fatty acids [ácidos graxos livres]; F-6-P — frutose-6-fosfato; GH — hormônio de crescimento; G-1-P — glicose-1-fosfato; G-6-P — glicose-6-fosfato; HK — hexoquinase; HMP — hexose monofosfato; PC — piruvato carboxilase; PEP — fosfoenolpiruvato; PEPCK — fosfoenolpiruvato carboxiquinase; PFK — fosfofrutoquinase; PK — piruvato quinase;TG — triglicérides. (Adaptado de Kitabchi et al. [8].)
 FIGURA 3-10 FIGURA 3-10
Patogênese da cetoacidose diabética (CAD) e da síndrome hiperglicêmica hiperosmolar (SHH). Alteração do metabolismo de gordura, proteína e carboidrato leva a alterações metabólicas em direção aos estados catabólicos e sintomas de poliúria, polidipsia, polifagia, diurese osmótica, desidratação grave e, se não tratada, coma e óbito. A marca registrada destes eventos é o estado de deficiência de insulina e aumento de hormônios contraregulatórios. Na SHH, além da relativa deficiência de insulina e maior desidratação, há também um maior grau de hiperglicemia (secundário a uma menor ingestão de fluidos) que na CAD. Embora o mecanismo para a ausência de um grau significativo de cetose e acidemia na SHH (em comparação com a CAD) não tenha sido inteiramente elucidado, foi demonstrado em um estudo que o nível do peptídio-C (como uma indicação de reserva de insulina pancreática) é cinco a dez vezes menor na CAD que na SHH [19]. Isto foi oferecido como uma explicação parcial para a ausência de cetonemia na SHH. Já que a quantidade necessária de insulina para sua ação antilipolítica é cerca de cinco a dez vezes menor que para a ação do transporte de glicose [20], segue-se que a maior a quantidade de insulina residual (peptídio-C) na SHH é suficiente para prevenir lipólise (e, portanto, a ausência de cetogênese na SHH). Esta quantidade de insulina não é suficiente para promover o transporte de glicose e seus metabolismo; logo, observa-se a hiperglicemia resultante na SHH sem um cetonemia grave. (Adaptado de Kitabchi et al. [4].)
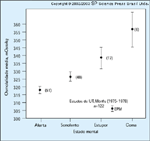 FIGURA 3-11 FIGURA 3-11
Osmolalidade sérica calculada em 122 pacientes com cetoacidose diabética com relação ao estado mental. Cerca de um terço dos pacientes com crises hiperglicêmicas podem se apresentar com um estado mental alterado [6]. Isto pode estar correlacionado com a osmolalidade sérica, mas precisa ser diferenciado de várias afecções clínicas associadas a um estado mental alterado ou coma (veja a Fig. 3-7), que podem estar presentes em pacientes diabéticos. (Adaptado de Kitabchi e Fisher [6].)
voltar |