  FIGURA 6-8 FIGURA 6-8
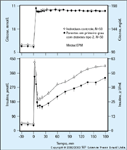
Concentrações plasmáticas de glicose (topo) e insulina (embaixo) em experimentos de clamp hiperglicêmico. Em resposta a uma elevação aguda de concentrações sangüíneas de glicose, a insulina é secretada de maneira bifásica, uma primeira fase durando aproximadamente 10 minutos seguida por uma segunda fase gradualmente crescente. A primeira fase da liberação de insulina foi vinculada a grânulos de insulina localizados perto da membrana de célula b (pool rapidamente liberável). A liberação da insulina da segunda fase depende em parte da mobilização dos grânulos de insulina de um pool de armazenamento para um pool rapidamente liberável, bem como de síntese aumentada de insulina. Neste estudo [15], indivíduos com tolerância normal à glicose mas com um parente em primeiro grau com diabetes tipo 2 foram estudados com o uso de um clamp hiperglicêmico para avaliar sua função de célula b e sensibilidade à insulina em relação a um grupo de indivíduos com tolerância normal à glicose, mas sem história familiar de diabetes. Os indivíduos eram equivalentes quanto à idade, gênero e obesidade para excluir fatores de risco ambientais (adquiridos). Foi demonstrado que indivíduos com um parente em primeiro grau com diabetes tipo 2 apresentaram redução na liberação precoce (primeira fase) e tardia (segunda fase) da insulina e não eram resistentes à insulina. (Adaptado de Pimenta et al. [15].)
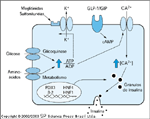 FIGURA 6-9 FIGURA 6-9
Detecção de nutrientes e secreção de insulina pela célula b pancreática. A célula b capta glicose e aminoiácidos via transportadores específicos na membrana celular, como o transportador de glicose GLUT2. Esta isoforma do transportador só é expressa pela célula b e pelo fígado e tem uma Km na faixa fisiológica. Uma vez dentro da célula, a glicose é fosforilada por uma forma especializada de hexoquinase chamada glicoquinase. O metabolismo subseqüente da glicose resulta em uma alteração na razão trifosfato de adenosina (ATP):difosfato de adenosina (ADP) dentro da célula que, por sua vez, causa ativação do canal de potássio sensível ao ATP. Isto resulta na despolarização da célula, em um influxo de cálcio e a subseqüente liberação da insulina dos grânulos secretores. O receptor de sulfoniluréia também pode ativar o canal de potássio sensível ao ATP, mimetizando o efeito da glicose. Outros secretagogos, como o peptídio-1 semelhante ao glucagon (GLP-1), se desviam deste sistema através da alteração dos níveis celulares de monofosfato de adenosina cíclico (cAMP). O nível de expressão das várias moléculas envolvidas na detecção de glicose, inclusive o transportador de glicose GLUT2, e o desenvolvimento da célula b são controlados por vários fatores de transcrição nucleares. Destes, os mais bem estudados são o HNF-1a, o HNF-1b, o HNF-4b e o PDX-1 (IPF-1). O diabetes da juventude com início na maturidade pode resultar de defeitos genéticos em qualquer um destes fatores de transcrição ou um defeito genético na glicoquinase. No diabetes tipo 2, o local exato do defeito na detecção de glicose é desconhecido, mas estudos em modelos animais da doença sugeriram que isto pode ser o resultado de uma regulação para baixo ['down-regulation'] do transportador de glicose GLUT2 [75].
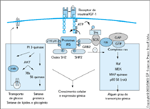 FIGURA 6-10 FIGURA 6-10
A rede de sinalização da insulina. A rede completa é complexa e pode ser dividida em cinco níveis: 1) ativação da tirosina quinase do receptor de insulina e eventos intimamente ligados; 2) fosforilação de uma família de proteínas de substrato; 3) interação do receptor e seus substratos com várias moléculas de sinalização intermediárias via SH2 (src homology 2) e outros domínios de reconhecimento; 4) ativação da serina e lípide quinases, resultando numa ampla gama de eventos de fosforilação-desfosforilação; e 5) regulação dos efetores biológicos finais da ação da insulina, como transporte de glicose, síntese lipídica, expressão gênica e mitogênese. As proteínas SH2 ligam as proteínas de substrato do receptor de insulina (IRS – insulin receptor substrate) a uma série de reações em cascata envolvendo serina/treonina quinases e fosfatases, como as proteínas quinases ativadas por mitógeno (MAP kinases), S6 quinases e proteína fosfatase-1A. Estas serina quinases agem sobre enzimas como a glicogênio sintase, fatores de transcrição e outras proteínas para produzir muitos dos efeitos biológicos finais do hormônio. No tecido adiposo e músculo, a estimulação pela insulina também aumenta a captação de glicose, promovendo a translocação de um pool intracelular de transportadores de glicose até a membrana plasmática. Não se sabe como exatamente esta ação é ligada à cascata de fosforilação, mas vários estudos sugerem que esta importante ação da insulina, bem como a maioria dos efeitos metabólicos, está a jusante da enzima fosfatidilinositol 3-quinase (PI 3-quinase). Outros efeitos da insulina, como a estimulação de síntese de glicogênio e lípides, ocorrem através de efeitos intracelulares adicionais para estimular as enzimas envolvidas nestas reações. ATP — trifosfato de adenosina; GAP — proteína ativadora de GTPase; GRB2 -proteína-2 de ligação ao receptor do fator de crescimento; GTP – trifosfato de guanosina; IGF — fator de crescimento semelhante à insulina; MEK — MAP-Erk quinase; SOS — proteína son-of-sevenless.
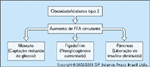 FIGURA 6-11 FIGURA 6-11
Resistência à insulina e obesidade. A resistência à insulina associada ao diabetes tipo 2 pode ser basicamente explicada pela obesidade, já que indivíduos comparavelmente obesos com e sem diabetes tipo 2 têm reduções quantitativamente semelhantes na ligação ao receptor de insulina, na atividade da tirosina quinase do receptor de insulina e no transporte muscular de glicose [42,76]. A maioria destas anormalidades em pacientes com diabetes tipo 2 pode ser normalizada por perda de peso [77]. Evidências atuais indicam que o fator mais importante envolvido na resistência à insulina da obesidade em seres humanos são os níveis circulantes aumentados de ácidos graxos livres (FFA – free fatty acids) plasmáticos [43]. Uma elevação experimental de FFA em seres humanos normais diminui a captação muscular de glicose e aumenta a produção endógena de glicose e, em modelos animais, compromete a secreção de insulina [78,79]. Todas estas ações promoveriam a hiperglicemia através da alteração das taxas de equilíbrio entre entrada e remoção da glicose da circulação. São dois os mecanismos para os efeitos do FFA: competição pelo substrato [80] e comprometimento da sinalização da insulina [81]. Produtos acetilados do metabolismo de FFA reduzem a oxidação da glicose via inibição da piruvato desidrogenase e ativam as serina/treonina quinases, possivelmente através de aumentos na proteína quinase C (theta), levando a uma atividade reduzida das proteínas do substrato do receptor de insulina (IRS – insulin receptor substrate). O principal efeito destas últimas parece ser uma redução no transporte de glicose [82-84].
 FIGURA 6-12 FIGURA 6-12
Estágios no desenvolvimento do diabetes tipo 2. Estudos longitudinais e transversais indicam que os indivíduos destinados a desenvolver diabetes tipo 2 passam por cinco estágios. O primeiro estágio começa ao nascimento, quando a homeostase da glicose é normal, mas os indivíduos encontram-se sob risco de diabetes tipo 2 por causa dos polimorfismos genéticos que os predispõem a se tornarem obesos e que limitam a capacidade das células b pancreáticas de compensar a resistência à insulina. Durante o estágio 2, reduções na sensibilidade insulina emergem como resultado de uma predisposição genética e de estilo de vida não-saudável, que são inicialmente compensadas por um aumento na função de células b de maneira que a tolerância à glicose permanece normal. Durante o estágio 3, a função de célula b e a sensibilidade à insulina deterioram, de tal maneira que, quando desafiadas, como durante um teste de tolerância à glicose ou uma refeição padronizada, a tolerância à glicose pós-prandial se torna anormal. Neste ponto, a função da célula b é claramente anormal, mas suficiente para manter concentrações normais de glicose plasmática em jejum. No estágio 4, como resultado de deterioração adicional no funcionamento de células b e agravamento da sensibilidade à insulina (provavelmente como resultado da hiperglicemia pós-prandial), as concentrações plasmáticas de glicose em jejum aumentam por causa de um aumento na produção basal endógena de glicose. Finalmente, no estágio 5, como resultado de uma deterioração adicional na função de células b (por causa de fatores genéticos e ambientais, como glico e lipotoxicidade), os níveis de glicose tanto em jejum como pós-prandiais atingem níveis diabéticos. IFG – impaired fasting glucose [comprometimento da glicose em jejum];TGD – tolerância à glicose diminuída.
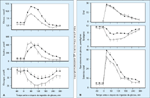 FIGURA 6-13 FIGURA 6-13
Comparação das alterações em hormônios (insulina e glucagon) e taxas de produção e utilização de glicose após ingestão de glicose em pacientes com tolerância à glicose diminuída (círculos fechados) e em pacientes saudáveis (círculos abertos). Pacientes com tolerância à glicose diminuída têm níveis plasmáticos normais em jejum de glicose, insulina e glucagon e taxas normais em jejum de produção e utilização de glicose. Entretanto, após um desafio de glicose oral ou uma refeição, eles apresentam uma liberação inicial reduzida de insulina durante os primeiros 30 a 60 minutos, acompanhada por um menor decréscimo nos níveis plasmáticos de glucagon (A). Estas anormalidades hormonais levam a uma redução na supressão da produção endógena de glicose com preservação do seqüestro esplâncnico normal da glicose ingerida. Conseqüentemente, uma quantidade de glicose acima do normal entra na circulação sistêmica (B). Isto excede as taxas de remoção de glicose da circulação durante 1 a 2 horas iniciais, de forma que os níveis plasmáticos de glicose aumentam mais que o normal. A hiperglicemia finalmente leva a níveis plasmáticos tardios e maiores que o normal de insulina que, juntamente com a hiperglicemia, fazem com que a utilização de glicose exceda a produção de glicose e, portanto, fazem com que a glicose plasmática acabe voltando aos níveis normais em jejum [85,86]. Durante o período pós-prandial de 4 a 6 horas, uma quantidade maior que o normal de glicose entrou na circulação e os níveis plasmáticos de glicose começaram em um nível normal e voltaram a um nível normal; portanto, é óbvio que uma quantidade de glicose maior que o normal foi removida da circulação. Embora a utilização tissular de glicose não esteja reduzida em pacientes com tolerância à glicose diminuída (TGD), ela é menor que aquela que teria sido encontrada em pacientes com tolerância normal à glicose cujos níveis plasmáticos de glicose e insulina eram equivalentes àqueles de pacientes com TGD, indicando que pacientes com TGD são resistentes à insulina [87]. (Adaptado de Mitrakou et al. [86].)
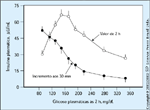 FIGURA 6-14 FIGURA 6-14
Comparação de respostas precoces e tardias de insulina plasmática durante testes orais de tolerância à glicose. A redução na secreção pós-prandial precoce (30 min) de insulina apresentou correlação com a supressão reduzida da produção endógena de glicose [86] e diminui progressivamente à medida que deteriora a tolerância à glicose [87]. Em contraste, os níveis de insulina após 2 horas aumentam inicialmente e só diminuem depois que os níveis plasmáticos de glicose após 2 horas atingem valores diabéticos [88]. Foi erroneamente interpretado que este último fenômeno implicava que a resistência à insulina ocorreria antes do comprometimento da secreção de insulina na evolução do diabetes tipo 2 [89], sendo agora evidente que isto resulta da hiperglicemia decorrente de uma liberação inicial atrasada da insulina [6,7,88,90].
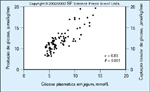 FIGURA 6-15 FIGURA 6-15
Produção e captação da glicose no estado pós-absortivo. Com uma deterioração adicional da função de células b, os níveis plasmáticos de glicose no estado de jejum aumentam como resultado da supressão comprometida da liberação hepática e renal de glicose pela insulina [52]. Isto se deve basicamente a um aumento na neoglicogênese [91-94]. Como mostra esta figura, a remoção de glicose da circulação também aumenta à medida que aumentam os níveis sangüíneos de glicose em jejum, ilustrando que a causa primária da hiperglicemia de jejum é a superprodução de glicose, e não uma redução na utilização de glicose. A produção aumentada de glicose resulta do comprometimento da função de células b, bem como da resistência à insulina, mediados em parte indiretamente pelos níveis plasmáticos aumentados de ácidos graxos, pela disponibilidade aumentada de substratos gliconeogênicos e pela ausência de uma supressão adequada da secreção de glucagon. (Adaptado de Dinneen et al. [52].)
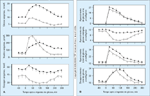 FIGURA 6-16 FIGURA 6-16
Comparação de alterações pós-prandiais nos níveis plasmáticos de insulina e glucagon (A) e taxas de aparecimento e remoção de glicose do plasma (B) em pacientes com diabetes tipo 2 e pacientes saudáveis. As anormalidades pós-prandiais em pacientes com diabetes tipo 2 (círculos fechados) são bem semelhantes àquelas de pessoas com tolerância à glicose diminuída (círculos abertos), exceto que são mais exageradas. A única diferença importante é que, com glicosúria excessiva, a captação de glicose no fígado está diminuída [51,52,95,96]. (Adaptado de Mitrakou et al. [51].)
voltar |