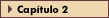 FIGURA 8-6 FIGURA 8-6
Produção hepática de glicose. Esquema simplificado das principais vias intracelulares de produção de glicose no fígado, glicogenólise e neoglicogênese (linhas grossas). Formas ovais sombreadas indicam enzimas-chave sensíveis à insulina na via. As concentrações de substratos estão entre colchetes; as enzimas sensíveis à insulina estão dentro de círculos, sombreados para indicar ação estimulante ou cinza para indicar ação inibitória. Embora a degradação de glicogênio aumente diretamente as concentrações intra-celulares de glicose-6-fosfato (G-6-P), a captação de lactato, alanina e outros aminoácidos neoglicogênicos fornece os precursores de 3 carbonos para a síntese de novo de G-6-P. G — glicose livre; GP — glicogênio fosforilase; GS - glicogênio sintase; G6P — glicose-6-fosfatase; GK — glicoquinase; PFK — fosfofrutoquinase; PEPCK — fosfoenolpiruvato-carboxiquinase; PC — piruvato carboxilase; PDH — piruvato desidrogenase; AA - aminoácidos; GLUT2 — isoforma 2 (não sensível à insulina) do transportador de glicose;TCA — ciclo dos ácidos tricarboxílicos.
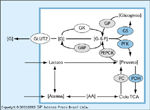
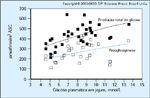 FIGURA 8-7 FIGURA 8-7
Contribuição da neoglicogênese para a concentração plasmática de glicose em jejum. Produção endógena total de glicose (mensurada pela técnica da diluição do rastreador) e neoglicogênese (determinada pela técnica de água deuterada [6]) foram simultaneamente mensuradas em indivíduos não-diabéticos em jejum e em pacientes com diabetes mellitus tipo 2. Como esperado (veja a Fig. 8-4), a produção endógena de glicose (quadrados cheios, linha sólida) está diretamente relacionada ao grau de hiperglicemia ao longo de uma faixa de concentrações plasmáticas de glicose em jejum. A neoglicogênese (quadrados vazios, linha azul) gera aproximadamente metade da produção total de glicose em indivíduos não-diabéticos e está aumentada em pacientes diabéticos, contribuindo, portanto, substancialmente para sua hiperglicemia de jejum [7]. ASC — área de superfície corpórea.
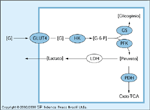 FIGURA 8-8 FIGURA 8-8
Captação periférica de glicose. Esquema simplificado de síntese de glicogênio e oxidação de glicose, as principais vias da captação intracelular de glicose nos tecidos-alvo da insulina. Formas ovais sombreadas indicam enzimas-chave sensíveis à insulina na via. G — glicose livre; G-6-P — glicose-6-fosfato; GLUT4 — isoforma 4 (sensível à insulina) do transportador de glicose; HK — hexoquinase II; GS — glicogênio sintase; PFK — fosfofrutoquinase; PDH — piruvato desidrogenase; LDH — lático desidrogenase;TCA — ciclo dos ácidos tricarboxílicos.
 FIGURA 8-9 FIGURA 8-9
(Veja a Lâmina Colorida) Ação da insulina no coração. O músculo miocárdico é sensível à insulina. Embora os ácidos graxos livres (FFA – free fatty acids) representem o combustível dominante para o músculo cardíaco no estado de jejum, um aumento nas concentrações circulantes de insulina inibe a lipólise, restringindo assim a disponibilidade de FFA e promovendo a captação de glicose. Com o uso de 18F-desoxiglicose (FDG), um análogo da glicose (que é transportado e fosforilado da mesma maneira que a D-glicose, mas não é adicionalmente metabolizado) marcado com um isótopo radioativo de vida curta do flúor (18F), a tomografia por emissão de pósitrons (PET – positron-emitting tomography) detecta um sinal que é proporcional à taxa de captação miocárdica de glicose. A figura mostra imagens de FDG do músculo cardíaco humano durante um estudo de clamp euglicêmico de insulina, como aquele ilustrado na Figura 8-3. As cores (com vermelho sendo o mais intenso) indicam as regiões com diferentes taxas de utilização da glicose. A, O ventrículo esquerdo de um paciente normal. B, As paredes ventriculares de um paciente que sofreu um infarto do miocárdio anterior 6 meses antes do estudo PET. Uma área "fria" de ausência de captação de glicose está claramente visível no canto superior direito (a parede anterior do ventrículo esquerdo). Está também evidente uma diminuição difusa na captação da glicose mediada pela insulina (resistência à insulina) por toda a parede ventricular esquerda, envolvendo regiões miocárdicas distantes da área infartada e normalmente perfundida (mapeamento da perfusão não mostrado) [8].
 FIGURA 8-10 FIGURA 8-10
Medição da captação intracelular de glicose e do gasto de energia in vivo via calorimetria indireta. O esquema ilustra a correspondência entre calorimetria indireta (na qual consumo de oxigênio = [O2 no ar expirado – O2 no ar inspirado] X fluxo de ar; produção de dióxido de carbono = [CO2 no ar expirado – CO2 no ar inspirado] X fluxo de ar) e o princípio de Fick (pelo qual o consumo de oxigênio = (O2 em sangue arterial – O2 em sangue venoso central) X débito cardíaco; produção de dióxido de carbono = (CO2 em sangue arterial – CO2 em sangue venoso) X débito cardíaco). Com o uso de equações calorimétricas, as taxas líquidas de oxidação de lípides e carboidratos e de gasto de energia podem ser quantificadas no corpo inteiro, bem como no nível do órgão começando com os dados de troca de gases. CE — coração esquerdo; CD — coração direito;VO2 — consumo de oxigênio;VCO2 — produção de dióxido de carbono.
 FIGURA 8-11 FIGURA 8-11
Curva dose-resposta para ação da insulina sobre a captação oxidativa de glicose e não-oxidativa de glicose no indivíduo saudável. A calorimetria indireta pode ser combinada com a técnica do clamp de insulina para estimar a oxidação de glicose nos vários platôs de insulina plasmática. A captação não-oxidativa de glicose, consistindo primariamente na síntese de glicogênio, é então obtida como a diferença entre a captação total de glicose e a oxidação líquida de glicose. A figura apresenta dados de indivíduos saudáveis estudados numa faixa de níveis plasmáticos de insulina; as linhas pontilhadas identificam os valores de Km para a captação oxidativa de glicose e a síntese de glicogênio. A oxidação de glicose tem uma alta sensibilidade e uma baixa capacidade; a síntese de glicogênio tem uma sensibilidade menor, mas uma capacidade maior. Portanto, sob condições fisiológicas, uma hiperinsulinemia leve estimula a oxidação de glicose, ao passo que uma insulinização mais forte promove o armazenamento de glicose no glicogênio. Estudos de clamp combinados com calorimetria regional demonstraram que o músculo esquelético é o tecido-alvo da insulina responsável pela maior parte (50% a 70%) da captação e armazenamento da glicose mediados pela insulina in vivo [9].
 FIGURA 8-12 FIGURA 8-12
Curvas dose-resposta para ação da insulina sobre o metabolismo lipídico. A calorimetria indireta também fornece estimativas para a oxidação líquida total de lípides. A oxidação de ácido graxo livre (FFA – free fatty acid) circulante pode ser medida pela coleta de CO2 marcado no ar expirado durante a infusão constante de palmitato marcado com carbono. A oxidação lipídica tissular é então definida como a diferença entre a oxidação lipídica total e a oxidação de FFA. Nos estudos de clamp em indivíduos normais resumidos na figura, doses baixas de insulina inibiram efetivamente tanto a oxidação lipídica total como a de FFA; doses fisiológicas altas de insulina (ou hiperinsulinemia crônica) não afetaram adicionalmente a oxidação de FFA, mas causaram síntese líquida de lípides (ie, valores negativos de oxidação lipídica). PC — peso corpóreo. (Dados de Groop et al. [10].)
voltar |